微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向浓度为1 mol/L的FeCl2溶液中通入足量的Cl2。下列有关溶液中离子浓度大小关系一定错误的是
A.原FeCl2溶液中:c(Cl-) > c(Fe2+) > c(H+) > c(OH-)
B.原FeCl2溶液中:2c(Fe2+) + c(H+) = c(Cl-) + c(OH-)
C.反应后的溶液中:c(Fe3+) > c(Cl-) > c(H+) > c(OH-)
D.反应后的溶液中:3c(Fe3+) + c(H+) = c(Cl-) + c(OH-)
参考答案:C
本题解析:原溶液被氯气氧化:2FeCl2+Cl2=2FeCl3,得到FeCl3溶液
FeCl2溶液中电荷守恒为:2c(Fe2+) + c(H+) = c(Cl-) + c(OH-),B正确
由于Fe2+部分水解,溶液呈酸性,故c(Cl-) > c(Fe2+) > c(H+) > c(OH-),A正确
FeCl3溶液中电荷守恒为:3c(Fe3+) + c(H+) = c(Cl-) + c(OH-) ,D正确
由于Fe3+部分水解,溶液呈酸性,故c(Cl-) > c(Fe
本题难度:一般
2、选择题 下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
①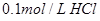 溶液??????????????????????????????????②
溶液??????????????????????????????????②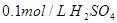 溶液
溶液
③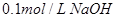 溶液?????????????????????????????④
溶液?????????????????????????????④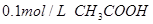 溶液
溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:氢离子浓度越大,首先越强,而pH越小。硫酸是二元强酸,盐酸是一元强酸,产生是一元弱酸,氢氧化钠是一元强碱,所以pH由小到大的顺序是②①④③,答案选B。
本题难度:简单
3、选择题 下列关于配制一定物质的量浓度的溶液说法正确的是(????)
A.把40gNaOH溶解于1L水中即得到1mol/L的的NaOH溶液
B.将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液
C.配制0.2mol/L的的CuSO4溶液480mL,需硫酸铜晶体的质量为25g
D.配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高
参考答案:C
本题解析:
试题分析:A、40gNaOH的物质的量为1mol,物质的量浓度=溶质的物质的量/溶液的体积,题中,只涉及溶剂的体积,未涉及溶质的体积,故无法计算。
B、没有讲明在标况下,故不能计算NH3的物质的量,故无法计算。
C、一定物质的量溶液的配制,其所用的容量瓶具有一定的规格,因此是无法配得任意体积的一定物质的量浓度的溶液的.此题中欲配制0.2mol/L的的CuSO4溶液480mL,应取用500mL容量瓶,所需CuSO4的物质的量为0.2×0.50=0.10mol,即16.00g,而硫酸铜晶体
本题难度:简单
4、选择题 水的电离平衡曲线如图所示。下列说法中,正确的是
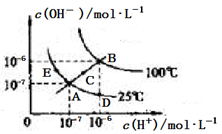
A.图中A、D、E三点处KW间的关系:E处>A处>D处
B.温度不变时,往水中通入适量HCl气体,可以使溶液中的离子浓度从A点变化到D点
C.温度不变时,在水中加入适量CH3COONa固体,可以使水的电离从A点变化到C点
D.在B点处,0.5mol·L-1的H2SO4溶液与1mol·L-1的KOH溶液等体积混合,充分反应后,所得溶液的pH=7
参考答案:B
本题解析:A错,KW只受温度影响,与其它因素无关,A、D、E三点处KW间的关系为E处=A处=D处;
B正确,往水中通入适量HCL气体,溶液中氢离子浓度增大,氢氧根离子浓度减小;
C错,温度不变,KW不变,在水中加入适量CH3COONa固体,可以使水的电离从A点变化到E点,溶液呈碱性;
D错,在B点处,0.5mol·L-1的H2SO4溶液与1mol·L-1的KOH溶液等体积混合,充分反应后,溶液呈中性,所得溶液的pH=6
本题难度:一般
5、填空题 (6分)KMnO4溶液与H2C2O4溶液可发生如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(1)该反应速率开始十分缓慢,一段时间后突然加快,这是因为_____(填化学式)对该反应具有催化作用。
(2)据此原理,可以利用KMnO4溶液来测定H2C2O4溶液的浓度,具体做法如下:
①准确配制0.10mol/L的KMnO4溶液
②将KMnO4溶液盛放在______滴定管中(填“酸式”或“碱式”)
③准确量取25.00mL H2C2O4溶液于锥形瓶中
④进行滴定
滴定终点有什么现象_________________,是否需要指示剂__________(填“是”或“否”)
(3)在下列操作中,会使测定的H2C2O4溶液浓度偏大的是___________。
①盛装KMnO4溶液的滴定管用蒸馏水洗净后未用KMnO4溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③盛装H2C2O4溶液的滴定管用蒸馏水洗净后,未用H2C2O4溶液润洗
④滴定后观察滴定管读数时,视线高于刻度线
(4)滴定时所得的实验数据如下,试计算所测H2C2O4溶液的浓度为_________mol/L
实验次数编号
| 待测液体积mL
| 滴入的标准液体积(mL)
|
1
| 25.00
| 28.95
|
2
| 25.00
| 25.05
|
3
| 25.00
| 24.95
参考答案:(6分)(1)MnSO4?(2)酸式?溶液由无色变为紫红色?
本题解析:(1)根据方程式可知,新生成的物质是硫酸锰和CO2,但CO2是气体,所以起催化作用的是硫酸锰。
(2)高锰酸钾溶液具有强氧化性,能腐蚀橡胶,所以应该用酸式滴定管盛放高锰酸钾溶液。由于酸性高锰酸钾溶液是显紫红色的,所以不需要另加指示剂终点时的现象是溶液由无色变为紫红色。
(3)①相当于稀释了高锰酸钾溶液的浓度,所以消耗高锰酸钾溶液的体积偏大,测定结果偏高。锥形瓶不能用标准液润洗,所以②不影响。③也是相当于稀释草酸的浓度,所以消耗高锰酸钾溶液的体积偏少,测定结果偏低。滴定后观察滴定管读数时,视线高
本题难度:一般
|