微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起 (??? )
A.溶液的pH增加
B.CH3COOH电离程度变大
C.溶液的导电能力减弱
D.溶液中c(OH—)减小
参考答案:A
本题解析:醋酸是若电解质,在溶液中存在电离平衡CH3COOH CH3COO-+H+,吸收促进电离,但溶液的酸性会降低,即pH是增大的。若加入少量醋酸钠晶体,则会增大醋酸根的浓度,抑制醋酸的电离,即pH也是增大的,但溶液的导电性是增强的,所以正确的答案是A。
CH3COO-+H+,吸收促进电离,但溶液的酸性会降低,即pH是增大的。若加入少量醋酸钠晶体,则会增大醋酸根的浓度,抑制醋酸的电离,即pH也是增大的,但溶液的导电性是增强的,所以正确的答案是A。
本题难度:一般
2、选择题 在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液中,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A.HNO2
B.HCOOH
C.HCN
D.H2CO3
参考答案:C
本题解析:略
本题难度:一般
3、选择题& nbsp; 下列说法正确的是[???? ]
A.CH4(g) +3/2O2(g) = CO (g)+2H2O(l) ΔH=-a kJ/mol,这ΔH代表燃烧热
B.在25℃、101kPa下,1mol S和2mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
参考答案:B
本题解析:
本题难度:一般
4、选择题 将0.1mol L-1的下列物质的水溶液,从常温加热到90℃,溶液的pH不变的是
A.氯化钠
B.硫酸
C.氢氧化钠
D.葡萄糖
参考答案:B
本题解析:
试题分析:氯化钠和葡萄糖溶液常温呈中性,pH=7,加热到90℃,Kw增大,c(H+)=c(OH-),溶液仍呈中性,但Kw增大,c(H+)和c(OH-)均增大,pH减小;0.1mol/L硫酸中c(H+)=0.2mol/L,加热到90℃,c(H+)不变,pH不变;0.1mol/LNaOH溶液中c(OH-)=0.1mol/L,升温到90℃,c(OH-)不变,但Kw增大,所以c(H+)增大,pH减小。
点评:水的电离是吸热过程,升高温度,Kw增大。
本题难度:一般
5、选择题 反应2C + O2=2CO 的能量变化如图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是
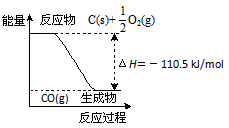 [???? ]
[???? ]
A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH (aq) + H2SO4(aq) = K2SO4(aq)+2H2O (l) ΔH=-114.6 kJ/mol
参考答案:A
本题解析:
本题难度:一般