微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
温度/℃
| 400
| 500
| 800
|
平衡常数K
| 9.94
| 9
| 1
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O
| CO
| CO2
| H2
| 甲 (质量/g)
| 1.8
| 8.4
| a
| 1
| 乙 (质量/g)
| 1.8
| 2.8
| 0
| 0
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡时,乙容器中CO的转化率为 &#来源:91考试网 91exam.org160; 。
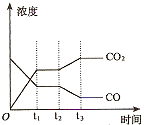
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
参考答案:(1)C3H8(g)+5O2(g)
本题解析:
本题难度:困难
2、选择题 将pH=5的H2SO4溶液稀释1 000倍后,溶液中SO浓度与H+浓度的比值约为
A.1∶10
B.1∶1
C.1∶2
D.1∶20
参考答案:D
本题解析:本题一定要注意H+浓度最终接近10—7mol/L,而c(SO)最终为 mol/L mol/L
本题难度:一般
3、选择题 下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=
参考答案:
本题解析:
本题难度:一般
4、选择题 MOH和ROH两种碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中正确的是(???)
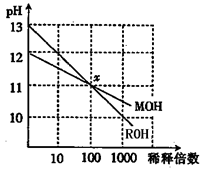
A.MOH是一种强碱
B.在x点,MOH完全电离
C.在x点,c(M+)==c(R+)
D.稀释前,c(ROH)==10c(MOH)
参考答案:C
本题解析:A.ROH是一种强碱,MOH为弱碱;
B.在x点,MOH和ROH溶液pH值相同;
D.稀释前,c(ROH中的OH-)==10c(MOH中的OH-);
本题难度:一般
5、选择题 常温时,将V1mLcl mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列结论正确的是
A.若Vl=V2,cl=c2,则溶液中一定存在c(H+)=c(OH-),是中性
B.若混合溶液的pH=7,则溶液中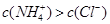
C.若混合溶液的pH=7,则一定存在c1V1>c2V2关系
D.若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的
参考答案:C
本题解析:A:若Vl=V2,cl=c2,则酸碱恰好中和,生成NH4Cl溶液,由于NH4+的水解,溶液呈酸性,不正确
B:溶液中一定存在电荷守恒c(H+)+c(NH4+)=c(OH-)c(Cl-),当pH=7时,c(H+)=c(OH-),必然有c(NH4+)=c(Cl-),不正确
C:当盐酸过量或恰好中和时,混合溶液均呈酸性,当混合溶液的pH=7,氨水一定过量,即一定存在c1V1>c2V2,正确
D:当Vl=V2,cl=c2时,酸碱恰好中和,溶液水解呈酸性,pH<7,排除
本题难度:一般
|
|