微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中生成物总能量高于反应物总能量的是?????????????(???)
A.氧化钙溶于水
B.铁粉与硫粉共热
C.强酸强碱中和
D.碳酸钙分解
参考答案:D
本题解析:反应中生成物总能量高于反应物总能量的反应为吸热反应,所以
A错,氧化钙溶于水属于放热反应;B错,铁粉与硫粉共热的反应属于放热反应;C错,酸碱中和反应为放热反应;D正确,碳酸钙分解属于吸热反应;
本题难度:简单
2、选择题 下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是(???)
A.铝热反应
B.铝与盐酸反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
D.灼热的炭与CO2反应
参考答案:D
本题解析:
试题分析:生成物的总能量高于反应物的总能量,说明反应是吸热反应,A、B是放热反应,C不是氧化还原反应,因此答案选D。
点评:一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,据此可以进行判断。
本题难度:一般
3、选择题 下列说法正确的是( )
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)
高温
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L ̄1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等
参考答案:A、反应需在300℃进行是为了获得较快的反应速率,不能说明反
本题解析:
本题难度:简单
4、实验题 100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
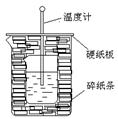
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是???? ????????????????????
(2)烧杯间填满碎纸条的作用是???????????????????????????????????。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量??????(填“相等”或“不相等”),所求中和热????????(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会???????;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案)??????????????KJ/mol。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)不相
本题解析:考查中和热的测定。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)实验过程中需要尽可能的减少热量损失,所以碎纸条的作用是减少实验过程中的热量损失。
(3)由于反应中生成的水不同,所以放出的热量不同。但中和热是不变的,因为中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量。
(4)氨水中存在电离平衡,电离吸热,所以测定结果偏小。
(5)根据题意反应中放出的热量是4.03×6.7×200×1.02+6.7×46.1=5817.074J=5.82kJ
所以反应
本题难度:一般
5、选择题 已知白磷和红磷在一定条件下可以互相转化。25OC 101kPa时,将等质量的白磷和红磷分别完全燃烧,其中白磷放出的热量多,由此判断,下列说法正确的是
A.由红磷转化为白磷是吸热反应,等质量的红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量的红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量的红磷能量比白磷低
参考答案:D
本题解析:略
本题难度:简单