微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)榴石矿石可以看作 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
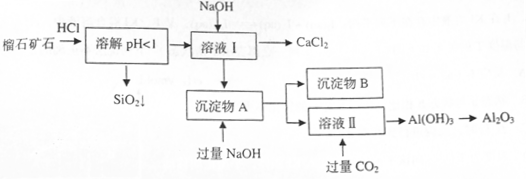
(1)榴石矿加盐酸溶解后,溶液里除了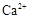 外,还含有的金属离子是????????。
外,还含有的金属离子是????????。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致????????????溶解,???????沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式??????????????????。
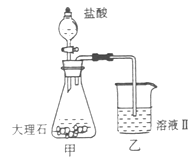
(4)①某同学在实验室中用图I装置制取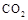 气体并通入溶液II中,结果没有沉淀产生,可能的原是???????????;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为???????????????。
气体并通入溶液II中,结果没有沉淀产生,可能的原是???????????;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为???????????????。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系???????????????????????????。
参考答案:(10分)
(1) 本题解析:(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸;
本题解析:(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸;
(2)向溶液I中加入NaOH溶液,NaOH不能过量,若NaOH过量可能会导致AL(OH)3溶解,氢氧化铝为典型的两性氢氧化物,同时可能会生成Ca(OH)2沉淀。控制溶液PH=9~10的目的是使Fe3+、AL3+变为沉淀,而Ca2+则不能生成沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液,其中氢氧化铝会与氢氧化钠溶液反应,而氢氧化铁沉淀则不溶于氢氧化钠溶液。其反应的离子方程式为: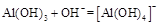 或AL(OH)3+OH—=ALO2—+2H2O;
或AL(OH)3+OH—=ALO2—+2H2O;
(4)①大理石与稀盐酸反应生成的二氧化碳气体中混有HCL、水蒸气等杂质气体,要使澄清石灰水能变浑浊只需将二氧化碳气体中的HCL气体除去,可将混合气体通入盛有饱和碳酸氢钠的洗气瓶中。
②石灰水变浑浊是生成了碳酸钙,其溶解平衡表达式为:CaCO3(s)?Ca2+(aq)+2OH—(aq)
本题难度:简单
2、选择题 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
| 气体 | a | b | C
A
NO2
浓硝酸
铜片
NaOH溶液
B
SO2
浓硫酸
铜片
酸性KMnO4溶液
C
NH3
浓氨水
生石灰
浓硫酸
D
H2
稀硫酸
锌粒
浓硫酸
A.A
B.B
C.C
D.D
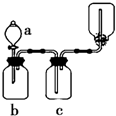
参考答案:A、NO2与NaOH反应而被吸收,不能用NaOH溶液净化,故
本题解析:
本题难度:一般
3、实验题 (12 分)以电石渣[主要成分是Ca(OH)2,含SiO2、Al2O3以及其它少量杂质]为原料生产氯酸钾联产碳酸钙的流程如下:
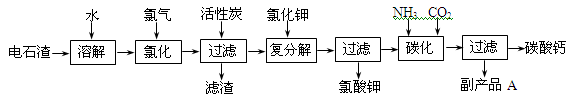
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
_____________________________________、__________________________________。
(2)氯化过程的温度控制在75~80℃,该过程主要反应的化学方程式为:
________________________________________________________________________。
(3)该流程中加入活性炭的作用是_____________________________________________。
(4)该流程中碳化反应的离子方程式为_________________________________________。
(5)副产品A的化学式为________________。
参考答案:(12分)
(1)Ca(OH)2 + SiO2 = C
本题解析:
试题分析:(1)SiO2、Al2O3都能与碱[Ca(OH)2]发生反应,方程式为:Ca(OH)2 + SiO2 = CaSiO3 + H2O ??Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O。
(2)氯化过程是反应掉多余的Ca(OH)2,化学方程式为6Cl2 + 6Ca(OH)2 Ca(ClO3)2 + 5CaCl2 + 6H2O。 Ca(ClO3)2 + 5CaCl2 + 6H2O。
(3)氯气有毒,且活性炭具有吸附作用,故加入活性炭的作用是吸附氯气,防止在后续实验中氯气逸出污染环境。
点评:本题是有关实验方案的设计和评价的考查,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般
4、实验题 (2014届上海市十三校高三测试化学试卷)
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
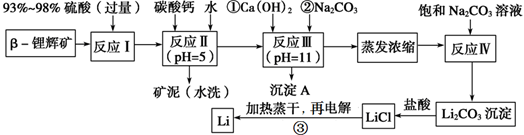
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
| Fe(OH)3
| Al(OH)3
| Mg(OH)2
| 开始沉淀pH
| 2.7
| 3.7
| 9.6
| 完全沉淀pH
| 3.7
| 4.7
| 11
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由? ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:
(流程常用的表示方式为: ) )
参考答案:
(1)2FeO+4H2SO4(浓)
本题解析:
(1)浓硫酸有氧化性,FeO有还原性,二者在加热时会发生氧化还原反应。根据质量守恒定律和电子守恒可得该反应的方程式为:2FeO+4H2SO4(浓)  Fe2(SO4)3+SO2↑+4H2O。 Fe2(SO4)3+SO2↑+4H2O。
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的剩余的H2SO4;调节溶液的pH,同时使Fe3+、Al3+完全转化为沉淀而除去。
(3)在反应Ⅲ中只需加入碳酸钠溶液,因为其碱性是盐水解产生的,碱性不如NaOH强,而且MgCO3的溶解度比Mg(OH)2大,不能很好的把Mg2+沉淀出去。因此不能达成该步骤的目的。
(4)加热蒸发时,只要看到大量固体析出或者仅余少量液体时,停止加热,利用余热把固体蒸干。
(5)步骤③中电解时,阳极产生的氯气中会混有少量氧气,是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应产生了LiOH混在LiCl中。LiOH受热分解生成Li2O,电解时产生了O2。
(6)水洗后的矿泥中含有Fe2O3、Al2O3、SiO2.可以先加盐酸把Fe2O3、Al2O3溶解变为FeCl3、AlCl3,除去难溶的SiO2.然后向溶液中加入过量的NaOH溶液,发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl。AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。把Fe(OH)3沉淀过滤除去,然后向滤液中通入过量的CO2气体,发生反应NaAlO2+ CO2+2H2O= Al(OH)3↓+NaHCO3.把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。另一种方法是把矿泥用NaOH溶液处理,可以得到NaAlO2和Na2SiO3溶液,而Fe2O3不溶,过滤除去。然后向滤液中加入过量的盐酸发生反应NaAlO2+4HCl= AlCl3+NaCl+2H2O。Na2SiO3+2HCl=H2SiO3↓+2NaCl。把硅酸沉淀过滤除去,再向滤液中通入过量的氨气,发生反应AlCl3+3NH3+3H2O= Al(OH)3↓+3NH4Cl。再把Al(OH)3沉淀过滤出来洗涤干净,然后灼烧既得Al2O3。
本题难度:一般
5、选择题 下列关于实验室制取乙烯的实验,其中说法正确的是(???)
A.乙醇和浓硫酸体积比为3∶1
B.温度计应插入反应物液体中
C.加热混合液至140℃左右
D.向浓硫酸中注入乙醇
参考答案:B
本题解析:略
本题难度:简单
|
|