微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取它用冰醋酸14.3 mL、95%乙醇 23 mL。还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要装置如图所示:
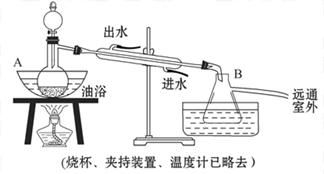
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是__________???????????????????????_______。
(2)用过量乙醇的主要目的是________????????????????????????????_________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是________????????????????????????___。
如果用NaOH溶液代替Na2CO3溶来源:91考试网 91ExAm.org液将引起的后果___________________________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____???????????????????????????______。
(5)在步骤⑧所得的粗酯里还含有的杂质是______??___。
参考答案:(1)作催化剂和吸水剂
(2)使酯化反应向生成乙酸乙
本题解析:
试题分析:在乙酸乙酯的反应中,浓硫酸做催化剂和脱水剂。根据勒沙特列原理,增加乙醇可以使反应向生产乙酸乙酯的方向移动,从而提高乙酸乙酯的产率。在这个试验中。饱和碳酸钠的作用主要有三个1.溶解乙醇。2.中和乙酸.3.降低乙酸乙酯的溶解。如果用氢氧化钠取代碳酸钠,则乙酸乙酯在碱性条件下会发生水解,造成收集不到乙酸乙酯,实验失败。乙酸与乙醇反应生成乙酸乙酯和水
本题难度:一般
2、选择题 收集NO和NO2两种气体[???? ]
A.都可用排水法???????????????
B.NO用排水法,NO2用向上排气法
C.都可用向上排气法???????????
D.NO用向上排气法,NO2用排水法
参考答案:B
本题解析:
本题难度:简单
3、实验题 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、???????????、摇匀。
②“步骤一”所得溶液的颜色为?????????????。
③写出“步骤二”中加锌粉产生气泡的离子方程式???????????????????????????????????;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式????????????????????????????。
④“步骤三”KMnO4溶液应装在????????式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是???????????? ??????????? ?;
判断滴定至终点依据的现象是??? ???????????????????????????????????????。
⑤实验测得该晶体中铁的质量分数为????????????????????。
参考答案:(共16分,每空2分)
①定容(有“定容”计2分,多答
本题解析:
试题分析:①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:黄色;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
⑤KMnO4具有强氧化性,应装在酸式滴定管中。滴定管使用前进行的操作是润洗。判断滴定至终点依据的现象是锥形瓶内溶液变红色且半分钟内不消失。
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×[(21.98mL+22.02mL)/2]×0.01 mol?L-1×10-3×10=.1.1×10-2mol,m(Fe)="56" g?mol-1×1.01×10-2mol=0.57g.晶体中铁的质量分数=0.57g/5g×100%=11.4%。
点评:本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题。
本题难度:一般
4、实验题 钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气,氢化钙通常用氢气与金属钙加热制取,图1是横拟制取装置。
 ?
?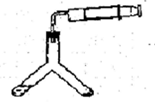
(1)用浓硫酸配制l:4(体积比)的稀硫酸,需用的玻璃仪器是烧杯、________。
(2)装置D中竖直导管的作用是________________________。
(3)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是_______。加热C装置前要对H2验纯,方法是:收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2__________________________。
(4)甲同学认为只要装置合理、操作规范就可以排除生成__________(选填序号)。
a.Ca3N2??????? b.CaO??? c.Ca(OH)2
(5)乙同学用上图装置测定制得的氢化钙的纯度。他称取46 mg样品,与足量水反应,恒温时,注射器量出产生的气体为48.06 mL(已换算为标准状况)。产生实验误差的原因可能是_______(选填编号)。
①H2通入不足,反应器中有空气
②钙与H2未充分反应
③产物与空气接触
(6)丙同学根据乙同学的实验数据列了一个关系式,42x+40y=0.046、2x+y=48.06/22400请指出式子中y的含义___________________________________。
参考答案:(1)玻璃棒、量筒(2分)?
(2)平衡压强,防止液体
本题解析:
试题分析:(1)用浓硫酸配制l:4(体积比)的稀硫酸,需用的玻璃仪器是烧杯、玻璃棒、量筒。
(2)装置D中竖直导管的作用是平衡压强,防止液体倒流 。
(3)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是无水硫酸铜,通过观察是否变成蓝色进行判断。加热C装置前要对H2验纯,方法是:收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2纯净。
(4)钙能和空气中的氮气,氧气及水都可能会反应,分别生成 a.Ca3N2??????? b.CaOc.Ca(OH)2,故选abc。
(5)根据CaH2 + 2H2O = Ca(OH)2?+ 2H2 。48.06 mL(已换算为标准状况)物质的量是0.002mol。CaH2的质量为0.084g,即84mg。结果偏大。①H2通入不足,反应器中有空气,可能会生成Ca3N2和CaO,Ca3N2 --- 2NH3,可能会使气体的量增大,结果偏大。②钙与H2未充分反应,必将会发生Ca---H2 ,也会使气体的量增大,结果偏大。③产物与空气接触后有部分气体放出,结果会偏小,错误;
(6)根据42,这是氢化钙的相对分子质量,40是钙的相对原子质量,可知42x+40y=0.046、2x+y=48.06/22400请指出式子中y的含义钙的物质的量。
本题难度:一般
5、实验题 (18分)某同学欲配制450mL 0.1mol/L的碳酸钠溶液,试根据所学回答下列问题。
(1)若采用5mol/L的碳酸钠溶液配制溶液,需要用到碳酸钠溶液的体积为???????。
(2)若用碳酸钠固体配制,一定会用到的仪器有________________________
A.450ml容量瓶????? B.500 ml容量瓶???? C.量筒??? D.胶头滴管
E.烧杯????????????? F.玻璃棒?????????? G.托盘天平
(3)欲准确配制所需溶液,下列称量质量正确的是????????????????(???)
A.称Na2CO3? 4.8克?????????????? B.Na2CO3 5.3克
C.称Na2CO3·10H2O? 12.87克????? D.称Na2CO3·10H2O 14.30克
(4)若在配溶液的过程中用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的碳酸钠固体
D.重新配制
(5)下列操作可能导致结果偏高的是?????????????????。
A.转移后没有洗涤烧杯
B.定容时俯视
C.定容时仰视
D.称取的Na2CO3溶液中混有少量Na2CO3·10H2O
E.配溶液前用碳酸钠溶液润洗容量瓶
参考答案:(1)0.01L或10ml 3分???(2)BDEFG? 5
本题解析:略
本题难度:简单