微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( ? )
A.H2O(g)=H2(g)+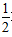 O2(g)△H=+242kJ?mol-1
O2(g)△H=+242kJ?mol-1
B.2H2(g)+O2(g)=2H2O(l)△H=-484kJ?mol-1
C.H2(g)+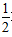 O2(g)=H2O(g)△H=+242kJ?mol-1
O2(g)=H2O(g)△H=+242kJ?mol-1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJ?mol-1
参考答案:A
本题解析:
本题难度:简单
2、填空题 已知:H2O(g)=H2O(l);△H=-44.0kJ/mol,将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_______________。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
参考答案:B2H6(g)+3O2(g)==B2O3(s)+3H2O(l
本题解析:
本题难度:一般
3、选择题 2?mol?NH3发生反应:2NH3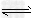 N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6?mol,反应吸收的热量为73.6?kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是 [???? ]
N2+3H2,达到平衡时,测得混合 气体的物质的量为3.6?mol,反应吸收的热量为73.6?kJ,下列表示氮气与氢气反应生成氨气的热化学反应方程式正确的是 [???? ]
A.3H2(g)+N2(g)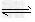 ?2NH3(g) ΔH=-92?kJ/mol
?2NH3(g) ΔH=-92?kJ/mol
B.3H2(g)+N2(g)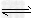 ?2NH3(g) ΔH=-368?kJ/mol
?2NH3(g) ΔH=-368?kJ/mol
C.3H2(g)+N2(g)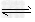 ?2NH3(g) ΔH=-73.6?kJ/mol
?2NH3(g) ΔH=-73.6?kJ/mol
D.3H2(g)+N2(g)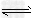 ?2NH3(g) ΔH=+73.6?kJ/mol
?2NH3(g) ΔH=+73.6?kJ/mol
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知下列热化学方程式
2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H =" -890.3" kJ/mol
1 g 氢气和1 g 甲烷分别燃烧后,放出的热量之比最接近
A.1 : 3.4
B.1 : 1.7
C.2.3 : 1
D.4.6 : 1
参考答案:C
本题解析:
试题分析:1 g 氢气燃烧放出的热量是571.6KJ/4="142.9kJ,1" g 甲烷燃烧放出的热量是890.3 kJ/16=55.6kJ,两者之比为2.6:1最接近2.3:1,答案选C。
考点:燃烧热的计算
本题难度:一般
5、选择题 在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O2(g)=CO(g) △H1= -110.5KJ/mol
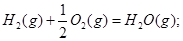
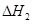 =
=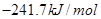

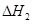 =
=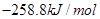
下列说法正确的是( )
A.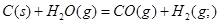 ;
;
B.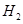 燃烧热的化学方程式为:
燃烧热的化学方程式为: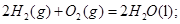
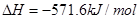
C.
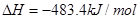
D.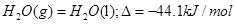
参考答案:D
本题解析:根据盖斯定律可知,①-②即得到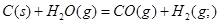 ,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。
,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。
本题难度:一般