1
2
O2(g)=H2O(g);△H=-242kJ?mol-1
请写出肼和氟气反应的热化学方程式:______;
(2)氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢.如图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
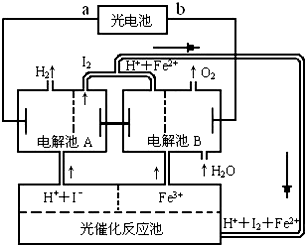
①判断光电池的a端为______极,b端为______极;
②写出电解池A中电极反应式:
阴极______,阳极______;
③电解池B中反应的离子方程式______;
④若电解池A中生成H2的体积为8.96L(标准状况下),则电解池B中生成Fe2+的物质的量为______.
参考答案:(1)由N2H4(g)+O2(g)=N2(g)+2H2O(g
本题解析:
本题难度:一般
2、选择题 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol???? CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol
H2O(g)=H2O(l)△H=-44KJ/mol?? 则CH4在空气中不完全燃烧时,热化学方程式是( )
A.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g)△H=-1038kJ/mol
B.4CH4(g)+7O2(g)=2CO2(g)+2CO(g)+8H2O(l)△H=-2642kJ/mol
C.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g)△H=-1497kJ/mol
D.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(l)△H=-1497kJ/mol
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
A.12ΔH3+5ΔH2-2ΔH1
B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1
D.ΔH1-5ΔH2-12ΔH3
参考答案: A
本题解析: 利用盖斯定律分析目标热化学方程式中各物质在已知方程式中的位置及各物质前系数,即可得出A项正确。
本题难度:一般
4、填空题 (16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ) Fe3O4(s) + H2(g) △H="a" KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H="b" KJ/mol (Ⅱ)
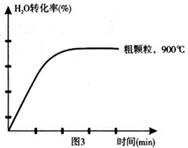
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。

(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
参考答案:(1)(2a+b)kJ/mol (2分)(无kJ/
本题解析:
试题分析:(1)已知H2O(g)+3FeO(s) Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4 Fe3O4(s)+H2(g)△H=akJ/mol(Ⅰ),2Fe3O4
本题难度:困难
5、填空题 Ⅰ 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
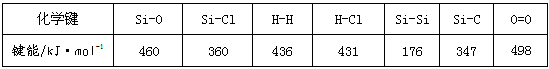
请回答下列问题:?
(1)比较下列两组物质的熔点高低(填“>”或“<”):?SiC________Si;SiCl4________SiO2。
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)?该反应的反应热ΔH= Si(s)+4HCl(g)?该反应的反应热ΔH=
__________kJ·mol-1。
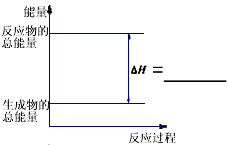
(3)请把下图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整。
Ⅱ 某实验小组设计下列实验
A 分别配制250mL 1.0 mol/L盐酸跟和250mL 1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。
试回答下列问题:?
(4)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有_____________ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有_____________
(5)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
___________(填“偏大”、“偏小”或“无影响”);
(6)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
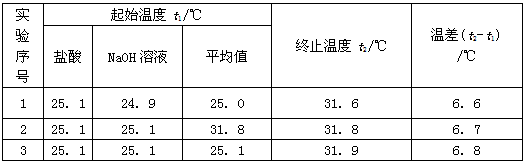
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.18×10-3kJ/(g·℃),则该反应的热化学反应方程式为____________________________。
参考答案:Ⅰ(1)>;<
(2)+236
(3)
本题解析:
本题难度:困难
|