微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HN 03,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体。这一奇 特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式:?????????????????????。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意???(填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+
参考答案:(1)加入适量的稀硫酸,用玻璃棒搅拌,(再加水稀释,)最后加
本题解析:
试题分析:(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,加入适量的稀硫酸,用玻璃棒搅拌,(再加水稀释,)最后加入少量铁粉(或铁屑,这是为了防止亚铁离子被氧化);(3)突然剧烈反应产生大量气泡,放出红棕色气体,该气体为二氧化氮,通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一),说明了含有硫酸根离子,该气体为氮气,并且可以判断出碳元素被转化为二氧化碳,所以向浓HNO3中滴入KSCN溶液反应的离子方程式为 ;设计K2S04溶液与浓硝酸作用的实验作为对照实验(验证硫酸钾与浓硝酸是否反应);(4)向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色,说明生成了(SCN)2,所以与氯气反应的离子方程式为:
;设计K2S04溶液与浓硝酸作用的实验作为对照实验(验证硫酸钾与浓硝酸是否反应);(4)向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色,说明生成了(SCN)2,所以与氯气反应的离子方程式为: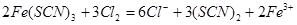 ,所以用SCN -间接检验Fe2+时加入氧化剂应注意少量,与SCN-反应使溶液变红的不一定是Fe3+。
,所以用SCN -间接检验Fe2+时加入氧化剂应注意少量,与SCN-反应使溶液变红的不一定是Fe3+。
点评:本题以铁离子的检验的实验为模型,结合实验过程中出现的试剂问题,设计了一个探究性的实验,本题有利于培养学生的探究性思维,本题综合性好,有一定的难度。
本题难度:一般
2、选择题 NA为阿伏加德罗常数,下列叙述中不正确的是
A.在标准状况下,2.24L二氯甲烷中所含分子数大于0.1NA
B.常温下,0.1mol甲烷与甲醛混合气体中所含碳原子数为0.1NA
C.0.1mol硅酸钠溶于水所得溶液中所含阴离子数等于0.1NA
D.1LpH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA
参考答案:C
本题解析:分析:A、标况下,二氯甲烷是液体,密度比气体的大,2.24L二氯甲烷物质的量大于0.1mol;
B、碳原子守恒,0.1mol甲烷与甲醛混合气体中所含碳原子的物质的量是0.1mol;
C、硅酸钠中的硅酸根离子发生了水解,使溶液中的阴离子的物质的量增加;
D、醋酸溶液中,氢离子来自水的电离和醋酸电离的氢离子,水电离的氢离子等于溶液中的氢氧根离子数目,醋酸根电离的氢离子等于醋酸根离子数目.
解答:A、在标准状况下,液体的摩尔体积等于22.4mol/L,2.24L二氯甲烷物质的量等于0.1mol,所含分子数大于0.1NA,故A正确;
B、0.1mol甲烷与甲醛混合气体中含有0.1molC,所含碳原子数为0.1NA,故B正确;
C、硅酸钠溶于水所得溶液中,硅酸根离子发生水解,由带两个负电荷的硅酸根离子离子转换称量2个带一个负电荷的氢氧根离子,使溶液中的阴离子数目增加,含阴离子数等于0.1NA,故C错误;
D、1LpH=1的醋酸溶液中,溶液中c(H+)=0.1mol,溶液中的氢离子来自醋酸的电离和水的电离;其中水电离的氢离子的数目═溶液中的氢氧根离子数目、醋酸根电离的氢离子数目=溶液中醋酸根离子数目,故CH3COO-和OH-数目之和为0.1NA,故D正确;
故选C.
点评:本题考查了阿伏伽德罗常数,注意标准状况下,液体的摩尔体积大于气体的,本题难度中等.
本题难度:一般
3、选择题 除去苯中所含的苯酚,可采用的适宜方法是( )
A.加70℃以上的热水,分液
B.加适量浓溴水,过滤
C.加足量NaOH溶液,分液
D.加适量FeCl3溶液,过滤
参考答案:A.加70℃以上的热水,虽然苯酚在此温度下易溶于水,但更易溶
本题解析:
本题难度:简单
4、简答题 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.请回答下列问题:
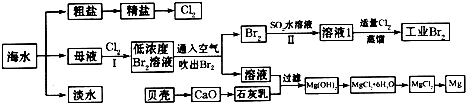
(1)请列举海水淡化的一种方法______.
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是______,所用主要仪器的名称是______.
(3)步骤I已经获得Br2,步骤II又将Br2还原为Br-,其目的是______.
(4)写出步骤II反应的离子方程式______.
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用______溶液进行洗涤除去.
(6)将MgCl2?6H2O直接加热能否得到MgCl2固体?______.用化学方程式解释出原因______.
参考答案:(1)工业常用蒸馏法或电渗析法淡化海水,故答案为:蒸馏法(或
本题解析:
本题难度:一般
5、选择题 现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,将氯化钠、乙醇、碘分别从以上各混合液中分离出来的正确方法依次是[???? ]
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
参考答案:C
本题解析:
本题难度:简单