微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 检验铵盐的方法是将待检物质取出少量放在试管中,然后
A.直接加热,用润湿的红色石蕊试纸在管口处试验
B.加水溶解,向溶液中滴加石蕊试液
C.加入强碱溶液加热后再滴入酚酞溶液
D.加苛性钠溶液加热,用润湿的红色石蕊试纸在管口处试验
参考答案:D
本题解析:铵盐是由铵离子(NH4+)和酸根离子构成,属于离子化合物。检验铵盐实质上是检验铵离子,检验铵离子的正确方法为:取样少许于试管中,加入氢氧化钠溶液加热,用润湿的红色石蕊试纸在管口处试验,若变蓝,则含有铵离子即为铵盐。也可以用蘸有浓盐酸的玻璃棒靠近气体,若能产生大量白烟的,则样品中含有铵离子即为铵盐。
本题难度:一般
2、选择题 下列说法正确的是( )
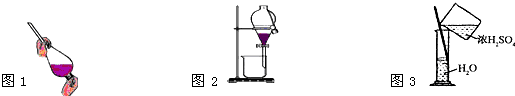
A.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
B.可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体
C.将乙醇与水分离,如图1、图2操作
D.稀释浓H2SO4,如图3操作
参考答案:B
本题解析:
本题难度:简单
3、实验题 富马酸亚铁(分子式为C4H2O4Fe,结构简式为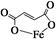 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图:
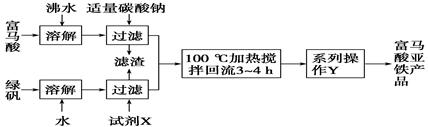
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
步骤
| 实验操作与现象
|
①
| 取富马酸亚铁产品1.5? g,加入稀硫酸25? mL,用水稀释至50? mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液
|
②
| ?
|
③
| ?
?
参考答案:(1)①HOOCHC===CHCOOH
②Fe2(SO
本题解析:
试题分析:(1)①由富马酸亚铁的结构简式可推断富马酸的结构简式为HOOCHC===CHCOOH,②由于亚铁离子不稳定,容易被氧化成三价铁离子,铁离子在溶液中会发生水解,生成氢氧化铁,所以绿矾(FeSO4?7H20)在保存过程中形成的杂质主要有硫酸铁、氢氧化铁等杂质③得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品;④富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验.所以检验方法是:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净.?
(2)检验亚铁离子的方法:滴加硫氰化钾溶液,溶液没有变成红色,证明溶液中没有三价铁离子;然后加入氧化剂将亚铁离子氧化成三价铁离子,溶液变成红色,证明原溶液中存在亚铁离子,结合题给试剂故答案为:
步骤
实验操作与现象
①
取富马酸亚铁产品1.5? g,加入稀硫酸25? mL,用水稀释至50? mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液
②
取少量滤液,滴加KSCN溶液,不显血红色
③
再向上述溶液中滴加H2O2溶液,溶液显血红色
考点:3+的水解性、Fe2+的还原性及检验知识.
本题难度:一般
4、选择题 现有①溴化钠溶液和溴水的混合溶液、②乙酸乙酯和乙酸钠溶液,分离它们的正确方法依次是( )
A.分液、蒸馏
B.蒸馏、分液
C.分液、萃取
D.萃取、分液
参考答案:①溴化钠溶液和溴水的混合溶液,因溴不易溶于水,易溶于有机溶剂
本题解析:
本题难度:简单
5、填空题 研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是??????????(填序号)。
① Cl2、Br2、I2?????② Na、Mg、Al???③烧碱、氢气??????④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示:

贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为????????????????????????????????????????????????????????。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为??????????????????????????????????????????????;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
参考答案:(1)④(1分);
(2)CaCO3(1分);?放热(
本题解析:
试题分析:(1)①从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,是化学变化,同样要得到氯气,需要电解熔融的氯化钠,也是化学变化,①不正确;②要从海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁,得钠和镁,是化学变化,故②错误;③电解饱和食盐水,得到烧碱、氢气和氯气,是化学变化,故③错误;④氯化钠在海水中的浓度很大,用蒸馏等方法可以从海水中得到淡水,海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得。同样经过蒸馏也可以得到淡水,属于物理变化,故④正确,答案选④。
(2)贝壳中的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和CO2。氧化钙溶于水得到氢氧化钙,该反应是放热反应;氢氧化钙与海水混合生成氢氧化镁白色沉淀,氢氧化镁内盐酸溶解生成氯化镁。镁是活泼的金属,要冶炼金属镁,需要电解熔融的氯化镁即得到镁和氯气,反应的化学方程式为MgCl2(熔融态) Mg+Cl2↑。 Mg+Cl2↑。
(3)氯气的氧化性强于单质溴的,因此氯气能氧化溴离子生成单质溴,反应的离子方程式为Cl2+2Br-=2Cl-+Br2;由于单质溴易溶在有机溶剂中,因此从反应后的溶液中提取溴单质的实验操作是萃取。
本题难度:一般
|