微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (11分)某学生课外活动小组模拟呼吸面具中的反应原理设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
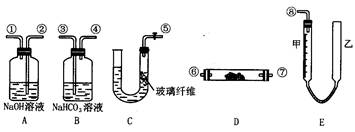
试回答:
(1)图中各装置接口连接顺序是______(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的反应物是______和______。
(3)装置A的作用是______,装置B的作用是______。
(4)写出D中发生反应的化学方程式并标出电子转移方向和数目。
(5)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中应注意____________(填字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲乙两管液面相平
d.读数时不一定使甲乙两管液面相平
参考答案:(1)⑤③④⑥⑦②①⑧(⑥、⑦可换位) (2分)
(2
本题解析:(1)实验意图应该是先制取CO2,然后除杂,再通入过氧化钠制O2,然后除去O2中的杂质,再测量O2的体积。所以,图中各装置接口连接顺序是⑤③④⑥⑦②①⑧(⑥、⑦可换位)
(2)装置C中放入的反应物是大理石和盐酸
(3)装置A的作用是除去混在O2中未反应的CO2;装置B的作用是吸收CO2中混有的HCl
(4)D中发生反应的化学方程式2Na2O2 + 2CO2?="=" ?2Na2CO3+ O2 (电子转移方向由过氧化钠中的氧原子指向它本身,是过氧化钠的歧化反应,转移2mol电子。)
本题难度:一般
2、选择题 在10 mL 0.01 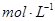 的纯碱溶液中,不断搅拌并逐滴加入2.4 mL 0.05
的纯碱溶液中,不断搅拌并逐滴加入2.4 mL 0.05 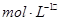 的盐酸,完全反应后,在标准状况下生成
的盐酸,完全反应后,在标准状况下生成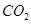 的体积为
的体积为
A.1.344 mL
B.2.240 mL
C.0.672 mL
D.0.448 mL
参考答案:D
本题解析:由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaCl=NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑。纯碱是1×10-4mol,盐酸是1.2×10-4mol,所以最终生成的CO2的物质的量是0.2×10-4mol,标准状况下的体积是0.448ml,答案选D。
本题难度:简单
3、选择题 某课外实验小组设计的下列实验不合理的是( )
A.
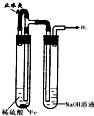
制备并观察氢氧化亚铁
B.

证明过氧化钠与水反应放热
C.
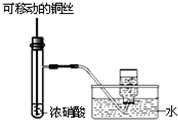
制备并收集少量NO2气体
D.
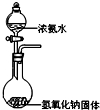
实验室制备少量氨气
参考答案:A.左试管中反应生成的H2充满了左试管和试管右,且外界空气不
本题解析:
本题难度:一般
4、选择题 把2.1 g CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足
量的Na2O2固体中,固体的质量增加( )
A.2.1 g
B.3.6 g
C.7.2 g
D.无法确定
参考答案:A
本题解析:由2H2+O2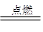 ?2H2O和2H2O+2Na2O2=4NaOH+O2↑得,H2+Na2O2=2NaOH,即固体增加的质量就是反应的H2的质量,同理得:CO+Na2O2=Na2CO3,即固体增加的质量就是反应的CO的质量,故选A项。
?2H2O和2H2O+2Na2O2=4NaOH+O2↑得,H2+Na2O2=2NaOH,即固体增加的质量就是反应的H2的质量,同理得:CO+Na2O2=Na2CO3,即固体增加的质量就是反应的CO的质量,故选A项。
本题难度:一般
5、计算题 现有Na2CO3?和NaHCO3的混合物共13.7g,现把混合物充分加热到不再有气体放出为止,发现混合物质量变为10.6g,试计算原混合物中Na2CO3的物质的量。
参考答案:解:设混合物中NaHCO3质量为mg.
本题解析:略
本题难度:一般