微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用穿有若干小孔的铝箔包裹0.100 mol Na并浸入过量的水中,化学反应快速、安全地进行。当反应结束时, 生成的气体在标准状况下的体积,一定是(??? )
A.等于1.12 L
B.等于4.48 L
C.小于4.48 L
D.大于1.12 L,小于4.48 L
参考答案:D
本题解析:Na和水反应生成NaOH和H2,铝再和NaOH溶液反应。
2Na? +? 2H2O="===2NaOH?" +? H2↑
0.1 mol? 0.1 mol??????? 0.05 mol
2Al? +? 2NaOH? + 2H2O====2NaAlO2+3H2↑
0.1 mol??????????????????????? 0.15 mol
现不知铝箔的量是多少,产生的H2的量:0.05 mol<n(H2)<(0.05+0.15) mol
1.12 L<
本题难度:简单
2、填空题 某无色透明溶液A,是由H+、Ba2+、Mg2+、OH-、 、
、 、
、 、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
(1)若A溶液呈明显的酸性,则除H+外,溶液中还可能有显著量的_________、_________、_________离子。
(2)若A溶液呈明显的碱性,则除OH-外,溶液中还可能有显著量的_________、_________、_________离子。
参考答案:(1)Cl- Ba2+? Mg2+? (2)Cl-? Ba2
本题解析:凡能与铝作用只放出H2的溶液,如果显酸性则不应含有 ,若显碱性应为强碱溶液。(1)若A溶液呈明显的酸性,则除H+外,溶液中还可存在与H+不反应的离子如Ba2+、Mg2+,还可能有强酸阴离子Cl-。(2)若A溶液呈明显的碱性,则除OH-外,溶液中还可能有大量的Cl-、
,若显碱性应为强碱溶液。(1)若A溶液呈明显的酸性,则除H+外,溶液中还可存在与H+不反应的离子如Ba2+、Mg2+,还可能有强酸阴离子Cl-。(2)若A溶液呈明显的碱性,则除OH-外,溶液中还可能有大量的Cl-、 本题难度:简单
本题难度:简单
3、选择题 已知Mg(OH)2和Al(OH)3是工业上常用的阻燃剂,它们的热化学方程式分别为:????Mg(OH)2(s)==MgO(s)+H2O(g);????△H1=+81.5kJ·mol-1
Al(OH)3(s)=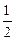 Al2O3(s)+
Al2O3(s)+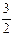 H2O(g);? △H2=+87.7kJ·mol-1
H2O(g);? △H2=+87.7kJ·mol-1
下列说法正确的是????????????????????????????????????????????????????????(???)
A.Mg(OH)2和Al(OH)3都是不溶于水的物质,所以可作工业阻燃剂。
B.等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好。
C.Mg(OH)2的碱性比Al(OH)3强,可推断金属性Al比Mg强。
D.Mg(OH)2和Al(OH)3作工业阻燃剂与它们分解产物都是耐高温材料无关。
参考答案:B
本题解析:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。所以,A、D说法不正确。B选项中:Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1,Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1等质量的Mg(OH)2比Al(OH)3吸热多,所以B说法正确。根据金属性强弱比较方法可知C说法不正确。则本题的选项为B。
本题难度:一般
4、选择题 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制碱式碳酸镁的实验步骤如下:??
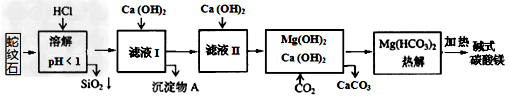
室温下,相关金属氢氧化物沉淀的KSP见下表1
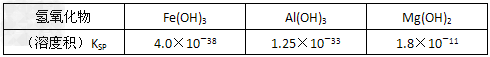
注:①?lg2=0.3,②离子的浓度小于1.0×10-5?mol·L-1时?,可认为该离子沉淀完全。下列说法不正确的是
[??? ?]
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3·b?Mg(OH)2·cH2O】高温加热分解得到6.6g?CO2和8.0g?MgO,由此可知a=3、b=1、c=3
参考答案:B
本题解析:
本题难度:一般
5、填空题 化合物甲是由短周期元素组成的陶瓷材料,是一种以共价键相连的物质,具有耐高温、抗冲击、导热性好等优良性质。乙是制备这种材料的起始原料,也是铝土矿的主要成分。制备时采取碳热还原氮化法,即把乙与炭粉按一定比例混合,在流动N2气氛中加热到一定温度即可得到甲和可燃性气体丙,二者原子个数之比均为1:1。8.2g甲与足量的氢氧化钠溶液混合可以得到无色溶液丁,并产生标准状况下4.48L气体戊。
(1)乙的化学式为?????????,写出它的一种用途?????????????????。
(2)甲的晶体类型为???????,写出碳热还原氮化法制甲的化学方程式???????????。
(3)工业制备甲的过程中可能含有的杂质有????????????。
(4)气体戊的结构式为?????????,写出甲与足量的氢氧化钠溶液反应的化学方程式为?????????????????,验证溶液丁中溶质的实验方法为??????????????????????。
参考答案:(1)Al2O3????耐高温材料(其他合理均可)?????
本题解析:
试题分析;据题意可知甲物质为二氧化硅,乙物质为氧化铝。二氧化硅为原子晶体。氧化硅与碳在氮气条件下,高温加热,可生成可燃性气体一氧化碳,。所以Al2O3 + 3C +N2 =2AlN + 3CO?。而AlN + NaOH +H2O=NaAlO2 + NH3。,检验NaAlO2的方法是取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2。主要是利用偏铝酸根离子在酸性条件下可转化为氢氧化铝,而氢氧化铝又溶于强酸的这个性质。
本题难度:一般