微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 ①pH=0的盐酸②0.5mol·L-1盐酸③0.1mol·L-1的NH4Cl溶液④0.1mol·L-1的NaOH溶液⑤0.5mol·L-1的NH4Cl溶液,以上溶液中水电离的c(H+)由大到小的顺序是( )
A.⑤③④②①
B.①②③⑤④
C.①②③④⑤
D.⑤③④①②
参考答案:A
本题解析:pH=0的盐酸中 ,0.5mol·L-1盐酸中
,0.5mol·L-1盐酸中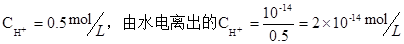 ,0.1mol·L-1的氢氧化钠溶液中
,0.1mol·L-1的氢氧化钠溶液中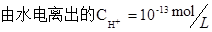 ,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。
,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。
本题难度:一般
2、选择题 常温下,某物质的水溶液中由水电离出的H+浓度为1×10-a mol/L,下列有关说法正确的是[???? ]
A.a<7时,该物质可能为HCl
B.a<7时,溶液的pH可能为a
C.a>7时,该物质可能为NH4Cl
D.a>7时,溶液的pH一定为14-a
参考答案:B
本题解析:
本题难度:一般
3、填空题 (12分)许多尾气中含有NOx、S02等造成空气污染的气体。根据要求回答下列问题:
(1)已知:N02(g)+CO(g)
参考答案:
本题解析:
本题难度:困难
4、选择题 室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
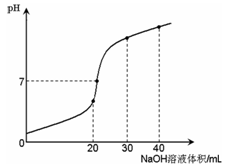
A.PH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)="=" c(NH3·H2O) + c(OH-)
D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
参考答案:C
本题解析:
试题分析:A、pH=7时,溶液呈中性,c(OH-)=c(H+),根据电荷守恒,则2c(SO42-)+ c(OH-)=c(H+)+ c(NH4+)+ c(Na+),2c(SO42-)=c(NH4+)+ c(Na+),此时氢氧化钠溶液的体积大于20mL,则c(Na+)>c(SO42-),所以c(SO42-)>c(NH4+),正确;B、当V(NaOH)=20mL时,氢氧化钠与硫酸氢铵的物质的量相同,则生成硫酸钠和硫酸铵的混合液,铵根离子的水解使溶液中水的电离程度比纯水大,正确;C、当V(NaOH)=30mL时,钠离子的物质的量是硫酸根离子或N元素物质的量的1.5倍,根据元素守恒c(Na+)=1.5[c(NH3·H2O)+ c(NH4+)]="1.5" c(SO42-),根据电荷守恒,则2c(SO42-)+ c(OH-)=c(H+)+ c(NH4+)+ c(Na+),所以将钠离子和铵根离子消去,得溶液中0.5 c(SO42-)+ c(H+)="=" c(NH3·H2O) + c(OH-),错误;D、因为硫酸根离子与钠离子都不发生水解反应,原溶液中硫酸根离子与钠离子的浓度相等,都是0.1mol/L,所以无论溶液的体积是多少,二者混合后溶液的总体积是相同的,则溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1,正确,答案选C。
考点:考查电解质溶液混合的计算,离子浓度的比较
本题难度:困难
5、选择题 (6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl
参考答案:
本题解析:
本题难度:一般