微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列数据有些明显不符合事实。其中不可信的是(????)
A.H—Cl的键能为432 kJ/mol,H—F的键能明显高于432 kJ/mol
B.0.1 mol/L氨水中NH3·H2O部分电离,一定温度下该氨水的电离度为55%
C.某Ca(OH)2溶液的浓度为0.5 mol/L
D.十六烷的裂化产物中不饱和烃的分子数超过50%
参考答案:BC
本题解析:非金属性越强,形成的共价键越稳定,A正确。一水合氨的电离程度,很小,不可能达到55%,B不正确。氢氧化钙是微溶性物质,其浓度达不到0.5mol/,C不正确。十六烷的裂化产物是辛烯和辛烷,D正确。答案选BC。
本题难度:一般
2、填空题 (16分)某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+??、Fe3+的氧化性、还原性,并对实验结果加于应用。
(1)兴趣小组通过对Fe2+、Fe3+ 的价态分析,对Fe2+、Fe3+ 的氧化性、还原性提出了如下3种假设:
假设一:Fe2+具有?????????????????????????性;
假设二:Fe2+具有?????????????????????????性;
假设三:Fe3+具有?????????????????????????性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
探究内容
| 实验方案
| ????实验现象
| 写出下列离子方程式
|
探究Fe2+具有还原性
| 取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量?????????
| 溶液先不变红,
后变为血红色
| ①Fe2+发生的反应:
|
探究Fe3+具有氧化性
| 取少量0.1mol·L-1FeCl3溶液,加入足量??????????后,再往溶液中加入少量KSCN溶液
| 溶液不变为血红色
| ②Fe3+发生的反应:
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn ="=" ZnCl2 + Fe
该反应的离子方程式为:???????????????????????????????????????????。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:???????????????????????????????????????????????。
参考答案:假设一:Fe2+具有?还原
本题解析:略
本题难度:一般
3、选择题 已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种铈的核素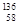 Ce、 Ce、 Ce、 Ce、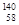 Ce、 Ce、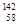 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体
参考答案:C
本题解析:根据题中信息可知铈是一种很活泼的金属,且氧化性Ce4+>Fe3+,由于Fe3+能氧化I-,故Ce4+也能氧化I-,因此铈与氢碘酸反应不能生成Ce4+,A项错误;B项中所给方程式电荷不守恒;D项中四种核素互为同位素
本题难度:一般
4、填空题 (7分)阅读下面两条科普信息,回答问题:①一个体重为50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形 式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示) 式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
(1)这两则科普信息分别介绍了人体内和海水中亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有??????性,铁离子具有?????性。
(2)①中的维生素C是??????????剂。②中的CO2是??????剂,CH2O是????????产物。
(3)已知含Fe3+的盐可用于净水,因为水解生成的氢氧化铁胶体具有吸附性,写出实验室制备氢氧化铁胶体的离子方程式???????????????????????????????????????
参考答案:
 本题解析:略 本题解析:略
本题难度:简单
5、选择题 下列转化需要加入氧化剂才能实现的是
A.H2S→H2
B.H2SO4→SO2
C.S→SO2
D.SO32-→SO2
参考答案:C
本题解析:化合价升高,被氧化剂氧化,故选C;A中氢化合价降低(+1价到0价),故需加还原剂;B中硫化合价降低(+6价到+4价),故需加还原剂;D中无元素化合价的变化
本题难度:简单
|