微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1∶100混合,反应后所得溶液pH=7。若x=y/2则x值为:
A.3
B.4
C.5
D.6
参考答案:B
本题解析:酸碱恰好中和,则10—x×V=10y—14×100V,并且x=y/2,求出x=4,答案为B
本题难度:一般
2、填空题 ⑴在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__???????__。
A.9????????? B.13???????? C.11~13之间????????? D.9~11之间
⑵25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__???????????????___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
⑶已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)????B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)????D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质是?????????,上述离子浓度大小顺序关系中正确的是(选填序号)????????????????????????。
②若上述关系中C是正确的,则溶液中溶质是??????????????????????????。
参考答案:(10分)⑴D(2分) ⑵C(2分)?⑶ ① 氯化铵 ,A
本题解析:
试题分析:(1)氨水是弱碱,稀释促进电离,OH-的物质的量是增加的。所以在25℃条件下将pH=11的氨水稀释100倍后溶液的pH介于9~11之间,答案选D。
(2)氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小,所以答案选C。
(3)根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知:
①若溶液中只溶解了一种溶质,该溶质是氯化铵。氯化铵水解,溶液显酸性,,则上述离子浓度
本题难度:一般
3、选择题 已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积KW=1.0×10-12 mol2·L-2。下列说法中正确的是
A.0.05 mol·L-1的H2SO4溶液,pH=1
B.0.001 mol·L-1的NaOH溶液,pH=11
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
参考答案:A
本题解析:A:c(H+)=0.1mol/L,pH=—lg c(H+)=1
B:c(OH—)=0.001mol/L,c(H+)=1.0×10-9mol/L,pH=—lg c(H+)=9
C:两者恰好中和,混合溶液的pH=6,溶液呈中性。
D:酸提供的n(H+)=1.0×10-3×0.05,碱提供的n(OH—)=1.0×10-1×V,可得V="0.5" mL
本题难度:一般
4、选择题 已知氢氰酸(HCN)的酸性比氢氟酸(HF)酸性弱。现有甲、乙两瓶等物质的量浓度的稀溶液,甲瓶中装的是NaCN溶液,乙瓶中装的是KF溶液,若用c(Na+)、c(H+)甲、c(OH—)甲、c(CN—)分别表示甲瓶中各种离子浓度,用c(K+)、c(H+)乙、c(OH—)乙、c(F—)分别表示乙瓶中各种离子浓度。对甲、乙两瓶溶液中各种离子浓度的比较正确的是(????)
A.c(OH—)甲+ c(CN—) > c(OH—)乙+ c(F—)
B.c(OH—)甲+ c(CN—) < c(OH—)乙+ c(F—)
C.c(OH—)甲+ c(CN—) = c(OH—)乙+ c(F—)
D.c(Na+)+ c(CN—) = c(K+) + c(F—)
参考答案:B
本题解析:
正确答案:B
c(OH—)甲+ c(CN—)= c(Na+)+ c(H+)甲,,c(OH—)乙+ c(F—)= c(K+)+c(H+)乙,,??F―水解能力小,c(H+)乙大,所以B正确;A、C不正确,CN—水解得多,D应为c(Na+)+ c(CN—) 〈 c(K+) + c(F—)
本题难度:简单
5、填空题 (4分)一般较强酸可制取较弱酸, 这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
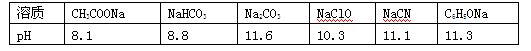
(1) 请根据上述信息判断下列反应不能发生的是________(填编号)。
A.CH3COOH+NaCN===CH3COONa+HCN
B.CO2+H2O+2NaClO===Na2CO3+2HClO
C.2HCN+Na2CO3―→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
(2)己知常温时Ksp(AgCl)=1.8×10-10 mol2.L-2,向50 mL 0.018 mo1.L-l的AgNO3溶液中加入相同体积0.020 mol.L-1的盐酸,则c(Ag+)=????????。
参考答案:(4分)? (1)?? B C ?(2)1.8×10-7 m
本题解析:
试题分析::(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答
本题难度:一般