微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列四种溶液①pH=0的盐酸②0.1 kJ·mol-1的盐酸③0.01 kJ·mol-1的NaOH溶液?④pH=11的NaOH溶液由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
参考答案:A
本题解析:①pH=0的盐酸由水电离出的氢浓度为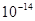 ,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为
,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为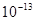 ,③0.01 kJ·mo
,③0.01 kJ·mo
本题难度:一般
2、选择题 常温下,取0.2 mol·L-1HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是(??)
A.c(Na+)-c(X-)=9.9×10-7mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1
D.混合溶液中由水电离出的c(OH-)=10-8mol·L-1
参考答案:A
本题解析:酸和碱的物质的量相等,反应后的溶液呈碱性说明该盐是强碱弱酸盐,所以酸是弱酸。A项,溶液呈电中性,溶液中阴、阳离子所带电荷相等,c(Na+)-c(X-)=c(OH-)-c(H+)=9.9×10-7mol/L,正确。B项,根据物料守恒得:c(Na+)=c(X-)+c(HX)=0.1 mol/L,错误。C项,根据物料守恒和电荷守恒得:c(OH-)= c(H+)+c(HX),错误。D项,混合溶液中由水电离出的c(OH-)=10-6 mol/L,错误。
本题难度:简单
3、实验题 (14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入???(填“酸式滴定管”或“碱式滴定管”),原因是???。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是???
(3)滴定时向待测液中加入的指示剂是???,到达滴定终点时的现象为???。
(4)用c 、V1和V2表示c(I3—)为???mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—)???(填“偏大”、“偏小”或“不变”)
参考答案:(14分)(每空2分)(1) 碱式滴定管;Na2S2O3溶液
本题解析:
试题分析:(1)Na2S2O3溶液是强碱弱酸盐,水解溶液显碱性,所以标准Na2S2O3溶液应装入碱式滴定管中;
(2)由于碘离子具有还原性,而空气中含有氧气,氧气能氧化碘离子,所以碘量瓶在震荡静置时要塞紧塞;
(3)由于碘遇淀粉显蓝色,所以滴定时向待测液中加入的指示剂是淀粉,到达滴定终点时的现象为溶液恰好由蓝色变成无色,且半分钟内不褪色;(4)1号瓶消耗V1mL Na2S2O3溶液,2Na2S2O3+I2=2NaI+Na2S4O6可知,20ml溶液中I2和I3-的总物质的量=1/2×V
本题难度:一般
4、选择题 下列关于热化学反应的描述中正确的是 [???? ]
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283. 0kJ/mol,则表示CO燃烧热的热化学方程为CO(g) +1/2O2(g)=CO2(g) △H=-283.0 kJ.mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
参考答案:B
本题解析:
本题难度:一般
5、选择题 用盐酸测定碳酸钠时既可用酚酞作指示剂又可用甲基橙(一种酸碱指示剂)作指示剂,现分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,下列说法中不正确的是? (??? )
A.用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl=NaHCO3+NaCl
B.用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl=NaCl+CO2↑+H2O
C.可用碱式滴定管量取所需要的Na2CO3溶液
D.若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低
参考答案:D
本题解析:
试题分析:分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,说明用酚酞作为指示剂,滴定的结果生成了NaHCO3,而用甲基橙作为指示剂,滴定的结果生成了NaCl,故AB正确;Na2CO3溶液显示出碱性,故可以用碱式滴定管量取;故C正确;若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏高,故D的说法是错误的,为本题的正确选项。
点评:本题考查了滴定的指示剂,该题可以扩展学生的视野,即采用不
本题难度:一般