微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是 ( )
A.常温下,某难溶物的Ksp为2.5×105
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.NH3·H2O溶液加水稀释后,溶液中 的值增大
的值增大
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
参考答案:B
本题解析:
试题分析:A.应该指明是何种物质的溶度积常数才有意义,错误;B.镀铜铁制品镀层受损后,Fe、Cu及周围的电解质溶液构成原电池,由于金属活动性Fe>Cu,所以首先被腐蚀的是Fe,因此铁制品比受损前更容易生锈,正确;C.NH3·H2O溶液加水稀释后,溶液中电离平衡正向移动,c(NH3·H2O)、c(NH4+)都减小,但是c(NH3·H2O)减小的倍数大于c(NH4+) 的值减小,错误;D.HCl对水的电离起抑制作用,而氯化铵水解对水的电离起促进作用,所以常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度不相同,错误。
的值减小,错误;D.HCl对水的电离起抑制作用,而氯化铵水解对水的电离起促进作用,所以常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度不相同,错误。
考点:考查物质的溶度积常数、原电池反应原理、弱电解质的稀释及影响水的电离程度的因素的知识。
本题难度:一般
2、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比 ( )
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:
正确答案:B
NaF是强碱弱酸盐,F++H2O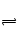 HF+OH
HF+OH
本题难度:一般
3、填空题 现有常温下的0.1 mol/l纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)="0.1" mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下pH均为a的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
参考答案:(1)CO32- + H2O 本题解析:
本题解析:
试题分析:(1) 纯碱碳酸钠是强碱弱酸盐。在溶液中存在的水解平衡主要是CO32- + H2O HCO3- + OH-,还有HCO3- + H2O
HCO3- + OH-,还有HCO3- + H2O H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O
H2CO3-+ OH-。由于消耗了水电离产生的H+,所以最终使溶液中的c(OH-)>c(H+)。因此溶液显碱性。再往溶液中滴加与CO32-形成沉淀的物质如BaCl2或CaCl2,此时会放出沉淀反应,消耗了CO32-,c(CO32-)减小,尽管水解程度增大,但是单位体积中的OH-的物质的量减少,所以溶液的碱性减弱,红色逐渐退为无色。(2)在Na2CO3溶液中主要存在水解平衡CO32- + H2O HCO3- + OH-。c(CO32-)(始)=" 0.1" mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O
HCO3- + OH-。c(CO32-)(始)=" 0.1" mol/L,若其水解程度等于10%,根据水解方程式可知:c(OH-)=0.01mol/L.c(H+)=10-12mol/L.pH=12.水解程度越大,水解产生的c(OH-)就越高,溶液的pH就越大。若水解程度小于10%,则c(H+)>10-12mol/L.pH<12.因此,测0.1 mol·L-1Na2CO3溶液pH,若pH≤12就证明0.1 mol/LNa2CO3中,发生水解的CO32—不超过其总量的10%。(3)A根据物料守恒可得c(Na+)=2c(CO32—)+2 c(HCO3—)+2c(H2CO3).所以c(Na+)>2c(CO32—) 。正确。B.在Na2CO3中存在水解平衡:CO32- + H2O HCO3- + OH-, HCO3- + H2O
HCO3- + OH-, HCO3- + H2O H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)="0.1" mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
H2CO3-+ OH-。主要是第一步水解,所以c(HCO3—)> c(H2CO3);但是盐水解的程度是很微弱的,盐的电离作用大于水解作用,所以c(CO32—)> >c(HCO3—)。由于两步水解都产生OH-,HCO3—第一步水解产生,而在第二步水解中由消耗。所以c(OH-)>c(HCO3—)。因此在溶液中离子间的关系为: c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)。正确。C.溶液显碱性。根据质子守恒可得:c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)。正确。D.根据物料守恒可得c(CO32—)+c(HCO3—)+ c(H2CO3)="0.1" mol/L.错误。E.根据电荷守恒可得c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+2c(CO32—).错误。(4)室温下pH均为a的Na2CO3溶液,c(H+)=10-a, c(OH-)(水)=10-14÷10-a =10a-14mol/L.对于pH=a的NaOH溶液c(H+)(水)= c(OH-)(水)=10-amol/L.所以水电离产生的c(OH—)之比=10a-14:10-a=10(2a-14)。
考点:考查盐的水解平衡、盐水解程度的测定、离子浓度的大小比较、相同pH的碱与盐的水的电离的知识。
本题难度:一般
4、选择题 下列有关说法正确的是 ( )
A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0
B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应
C.为保护海轮的船壳,常在船壳上镶入锌块
D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动
参考答案:C
本题解析:
试题分析:A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,根据ΔG=ΔH-TΔS<0,说明该反应的ΔH<0;B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是吸热反应,不是放热反应; C.为保护海轮的船壳,常在船壳上镶入锌块,锌块与船壳构成原电池的两极,锌块为阳极,保护阴极船壳; D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+是阳离子,向阴极移动。
考点:反应的自发性、水解原理、金属的电化学保护、电解原理综合。
本题难度:一般
5、填空题 (1)碳酸钾溶液蒸干灼烧得到的固体物质是 ____,原因____。
(2) KAl(SO4)2溶液蒸干得到的固体物质是___,原因是____。
(3)碳酸氢钡溶液蒸干得到的固体物质是___,原因是____。
(4)亚硫酸钠溶液蒸干得到的固体物质是___,原因是____。
(5)氯化铝溶液蒸干灼烧得到的固体物质是___,原因是____。
参考答案:(1)K2CO3 ;尽管加热过程促进了K2CO3的水解,但生
本题解析:
本题难度:一般