微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是(???? )
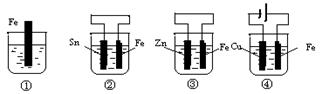
A.④>②>①>③
B.②>①>③>④
C.④>②>③>①
D.③>②>④>①
参考答案:A
本题解析:
试题分析:以①作参照物,进行比较。在②中构成了原电池。由于活动性Fe>Sn,所以Fe作负极,加快了Fe的腐蚀,因此②>①,在③中构成了原电池。由于活动性Zn>Fe,所以Zn作负极,首先被腐蚀的的是Zn Fe得到了保护,腐蚀比原来慢。因此腐蚀速率①>③。④构成的是电解池,Fe是活性电极。由于Fe与电源的正极连接,作阳极,发生反应:Fe-2e-=Fe2+.腐蚀的速率比作原电池的负极还要快。因此腐蚀速率④>②。所以铁在其中被腐蚀时由快到慢的顺序是④>②>①>
本题难度:一般
2、填空题 对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3?????? b.CO2????? c.NaOH????? d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是???????????。
(3)利用下图装置,可以模拟铁的电化学防护。
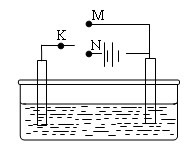
若X为碳棒,为减缓铁的腐蚀,开关K应该置于????? ???????????处。
???????????处。
若X为锌,开关K置于M处,该电化学防护法称为???????????????。
参考答案:
(1)①2Al + 2OH- + 4H2O=2Al(
本题解析:略
本题难度:简单
3、选择题 为了保护地下钢管不受腐蚀,可以将钢管与(??????)
A.直流电源的正极相连
B.与铜板相连
C.与锌板相连。
D.与锡板相连
参考答案:C
本题解析:考查金属的电化学腐蚀及防护。
采用牺牲阳极保护法时,可将钢管与活性较强的金属组成原电池,例如与锌板相连;采用电解池方法保护时,可将钢管与电源的负极相连即可,故答案为C
本题难度:简单
4、选择题 下图各容器中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序是
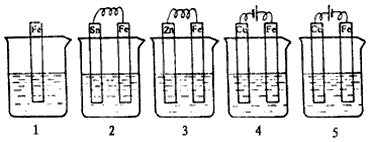 [???? ]
[???? ]
A.4>2>1>3>5
B.2>1>5>3>4
C.5>2>1>3>4
D.4>3>1>2>5
参考答案:A
本题解析:
本题难度:简单
5、选择题 如图所示:甲为稀硫酸,乙为氯化铜溶液,电极材料用元素符号表示,则下列说法中正确的是
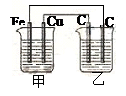
A.甲装置将电能转变为化学能
B.乙装置中左边的碳棒上有红色金属析出
C.甲中Cu为阳极
D.甲中Fe的质量少了0.56g,乙中右边的碳棒质量增加了0.64g
参考答案:D
本题解析:
试题分析:铁和稀硫酸反应生成氢气,则根据装置图可知,甲是原电池,乙是电解池,A不正确。甲中铁是负极,铜是正极。所以乙装置中左边的碳棒是阳极,溶液中的氯离子放电,生成氯气,B不正确;C不正确,D正确,0.56g铁是0.01mol,失去0.02mol,则根据电子的得失守恒可知,乙中右边的碳棒析出铜的物质的量是0.01mol,质量是0.64g,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻
本题难度:一般