微溶
?
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①???????????????????????;②???????????????????????????????
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。
 ?????? ??????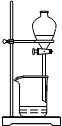  ???????? ???????? ??????? ???????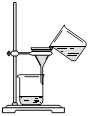
A????????????????? B????????????????? C????????????????? D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有?????????????????。
参考答案:(1)乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸
本题解析:
试题分析:(1)应该选择乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发。
(2)在浓硫酸加热条件下会生成副产物醚和发生消去反应,故为CH3CH2CH2CH2OCH2CH2CH2CH3 ????和CH3CH2CH=CH2。
(3)从化学平衡移动的角度分析可知①增加乙酸浓度?②减小生成物浓度(或移走生成物)可以使平衡右移,有利于酯的生成;
(4)前者主要是萃取选A后者是分液选择B。
(5)检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。
本题难度:一般
3、选择题 下列有关离子检验的方法正确的是
A.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl-
B.某溶液中加入氢氧化钠溶液立即有白色沉淀产生,该溶液中一定有Al3+
C.某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32-
D.某溶液中加入稀盐酸无现象,加入氯化钡溶液有白色溶液产生,该溶液中一定有SO42-
参考答案:D
本题解析:
试题分析:A、和银离子反应生成白色沉淀的可以是氯离子、SO42-或CO32-,错误;B、能和NaOH反应生成白色沉淀的可以是氢氧化镁或氢氧化铝,错误;C、加入稀盐酸能产生气体使澄清石灰水变浑浊的可以是CO2和SO2,因此可以是碳酸根、碳酸氢根、亚硫酸根、亚硫酸氢根,错误;D、加入BaCl2产生白色沉淀,可以是氯化银或硫酸钡,错误。
本题难度:一般
4、填空题 (17分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
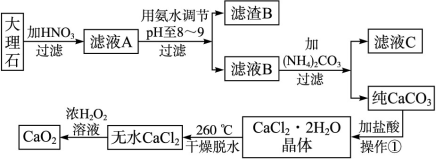
请回答下列问题:
(1)操作①中应包括?????????、?????????、?????用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9] )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )????????c(NO )????????c(NO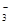 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为???????????????。 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为???????????????。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式??????????????????????????????????????。
参考答案:(1)溶解、过滤、蒸发结晶(3分);除去Fe3+或使Fe3+
本题解析:
试题分析:(1)沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体;因大理石中的主要杂质是氧化铁,它与硝酸反应生成了Fe(NO3)3,在调节pH到8~9时,Fe3+会以Fe(OH)3沉淀形式进入滤渣,从而除去了杂质离子Fe3+。
(2)根据离子积Ksp(CaCO3)=4.96×10-9=c(Ca2+)·c(CO ),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。 ),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
(3)由电荷守恒:c(H+)+c(NH )=c(OH-)+c(NO )=c(OH-)+c(NO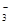 ),因c(H+)>c(OH-),故c(NH ),因c(H+)>c(OH-),故c(NH )<c(NO )<c(NO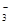 )。 )。
(4)由CaCl2+H2O2 CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。 CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
(5)CaO2中O元素的化合价为—1价,部分化合价升高转化为O2,部分化合价降低转化为Ca(OH)2,所以化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑
本题难度:困难
5、实验题 将煤焦油中的苯、甲苯和苯酚进行分离,可采取如下图所示方法和操作:

(1)写出物质①和⑤的分子式:①___________;⑤____________。
(2)写出分离方法②和③的名称:②____________; ③_____________ 。
(3)混合物加入溶液①反应的化学方程式为___________。
(4)下层液体④通入气体⑤反应的化学方程式为 __________________。
(5)分离出的苯酚含在___________中。
参考答案:(1) NaOH ;CO2
(2)分液 ;蒸馏
本题解析:
本题难度:一般
|