1.88×103
T1____573K(填“>”、“<”或“=”)。
 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应: (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1 4NO(g)+6H2O(g) △H=-905kJ·mol-1
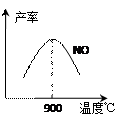
不同温度下NO产率如图所示。 温度高于900℃时,
NO产率下降的原因???????????????????????????????。
(4)吸收塔中发生反应的化学方程式为:
?????????????????????????????????????????????????????????????????????。
(5)上述工业流程中,采用了循环操作工艺的是?????(填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);?△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);??△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
参考答案:
(1)① 1(2分);?② 50%(2分);??(2
本题解析:略
本题难度:一般
2、实验题 如图是一个制取氯气并以氯气为原料进行特定反应的装置。

(l)A是氯气发生装置,写出其中的化学反应方程式???????????。
(2)a仪器的名称为???????????。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式?????????,装置C的作用是??????????。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为???????。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为???????????(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是????????;若发现装置B中该现象不明显,可能的
原因是????????;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式?????????????????????????。
参考答案:(1)MnO2+4HCl(浓) 本题解析:(l)依据装置分析可知实验室制备氯气利用二氧化锰和浓盐酸加热反应生成;(2)根据仪器的名称判断; 本题解析:(l)依据装置分析可知实验室制备氯气利用二氧化锰和浓盐酸加热反应生成;(2)根据仪器的名称判断;
(3)氯气有强氧化性,碳有还原性,在加热条件下氯气和水、碳发生氧化还原反应;氯化氢气体极易溶于水,且水能提供水蒸气,据此分析;
(4)紫色石蕊试液遇酸变红,但次氯酸有漂白性,据此分析;
(5)氯化氢、次氯酸和澄清石灰水反应都生成可溶性的盐和水;
(6)根据B装置内气体的压强变化分析液面变化;若发现装置B中该现象不明显,可能是A或B装置漏气,氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,
本题难度:简单
3、填空题 A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
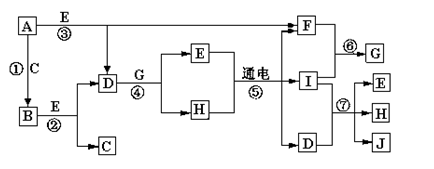
回答下列问题:
(1)B的化学式:?????,E的电子式_________。
(2)写出反应⑦的离子方程式??? __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴、阳”)极附近溶液由无色变为红色,其原因是_________________ 。
参考答案:(1)Na2O2(2分) 本题解析: 本题解析:
常温下A为固体单质,B为淡黄色粉末,则A为Na,B为Na2O2,那么C为O2,E在常温下为液体,应为H2O,则F为H2, D为NaOH,H的水溶液在通电的情况下反应生成H2、I和NaOH,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl, H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,则
(1)B的化学式:Na2O2;E的电子式 本题难度:一般 本题难度:一般
4、填空题 (12分)(1)氯气可溶于水,常温下,1体积水中溶解2体积的氯气,溶于水的氯气一部分与水反应,该化学方程式是???????????????。
(2)多余氯气常用NaOH溶液吸收,写出化学方程式?????????????????
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是____________;过一会儿,溶液颜色逐渐褪去,起作用的成分是____________;往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是________________。
参考答案:(1)(3分)Cl2 + H2O =" HCl" +HClO
本题解析:
试题分析:(1)氯气与水反应的化学方程式为Cl2+H2O=HCl+HClO;
(2)氯气与NaOH溶液反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O
(3)氯气是氯气溶于水后形成的溶液,而溶于水的氯气只占一部分,因此氯水中的主要成分有H+、Cl-、ClO-、HClO、Cl2、H2O。使紫色石蕊试纸变红的应为酸,故起作用的成分应为H+;褪色主要是HClO的强氧化性;产生的白色沉淀为AgCl,因此起作用的为Cl-。
点评:本题考查了氯气的性质,属于基础题。只要掌
本题难度:一般
5、选择题 在a、b、c、d四个集气瓶中分别盛有H2、Cl2、HCl、HBr中的任一种气体,若将a和d两瓶气体混合后见光爆炸;若将a和b两瓶气体混合后,瓶壁上出现暗红色液滴,则a、b、c、d四个集气瓶中分别盛放的气体是(?????)
A.Cl2、H2、HCl、HBr
B.Cl2、HCl、HBr、H2
C.Cl2、HBr、H2、HCl
D.Cl2、HBr、HCl、H2
参考答案:D
本题解析:根据题给信息可知a为Cl2,而与b瓶相遇出现的暗红色液滴是单质溴,b瓶盛放的只能是HBr,A、B选项均不是HBr,所以不符合要求。又a、d气体混合见光会爆炸,则d瓶中应是H2,而不是HCl,故只有D选项正确。
本题难度:一般
|