微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 COCl2俗名光气,是有毒气体。在一定条件下,可发生的化学反应为:
 。下列有关说法正确的是 [???? ]
。下列有关说法正确的是 [???? ]
A.?在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.?当反应达平衡时,恒温恒压条件下通入Ar,化学反应速率不变
C.?单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态
D.?恒温恒容下,充入1mol光气达到平衡后,再充入等量的CO与Cl2,光气的体积分数增大
参考答案:D
本题解析:
本题难度:一般
2、选择题 已知mX(g)+nY(g)?gZ(g)的△H<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的密度变小
D.增加X的物质的量,Y的转化率降低
参考答案:A、已知mX(g)+nY(g)?gZ(g)的△H<0,升高温
本题解析:
本题难度:简单
3、填空题 非金属元素氮有多种氧化物,如NO、NO2、N2O4等。
(1)对反应N2O4(g)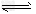 2NO2(g),ΔH=+57?kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是__________
2NO2(g),ΔH=+57?kJ/mol在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是__________
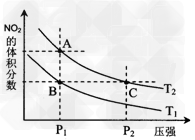
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C?
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(2)在100℃时,将0.400mol的NO2气体充入2?L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
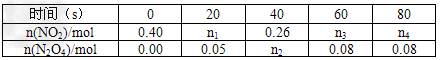
①在上述条件下,从反应开始直至20?s时,二氧化氮的平均反应速率为_____。
②该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正________v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将_________(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_________(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
(3)肼(N2H4)通常是航天航空的重要燃料,我们常用的一种肼燃料电池,是以肼与氧气的反应为原理设计的,其电解质溶液是KOH溶液。写出该电池负极的电极反应式________________________。
参考答案:(1)D
(2)①0.0025?mol·(L·s)-1
本题解析:
本题难度:一般
4、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述错误的是 [???? ]
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是 [???? ]
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:B
本题解析:
本题难度:一般
5、填空题 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放
100mL 6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解。
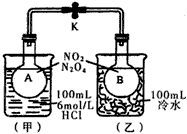
(1)A瓶中气体颜色______________,理由是__________________________。
(2)B瓶中气体颜色______________,理由是__________________________。
参考答案:(1)加深;酸碱中和反应放出热量,使平衡2NO2![]()
本题解析:
本题难度:一般