微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式____________
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是___________?????????????????
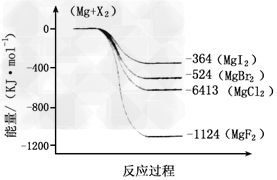
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.MgBr2与Cl2反应的△H<0
D.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa?时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
①?该反应的离子方程式为____________,平衡常数表达式为_______________
②在上述平衡体系中加入少量NaCl固体,平衡将_________(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将__________,氯气和水反应的平衡常数将__________(填“变大”、“变小”、“不变”)。
③已知:
H2CO3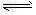 HCO3-?+?H+??Ka1(H2CO3)?=?4.45×10-7???
HCO3-?+?H+??Ka1(H2CO3)?=?4.45×10-7???
HCO3-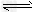 CO32-?+?H+???Ka2(H2CO3)?=?5.61×10-11
CO32-?+?H+???Ka2(H2CO3)?=?5.61×10-11
HClO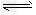 H+?+?ClO-?????Ka(HClO)?=?2.95×10-8
H+?+?ClO-?????Ka(HClO)?=?2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
2、选择题 下列说法正确的是?
 [???? ]
[???? ]
A、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 ???
B、25℃、101?kPa时,1?mol?S和2?mol?S的燃烧热不相等 ???
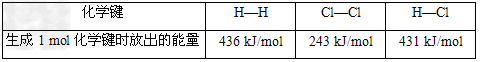
C、通常人们把拆开1?mol某化学键所吸收的能量看成该化学键的键能。如上图,则
 ?
?
D、将1?mol一氧化碳和1?mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6?mol二氧化碳,再加入2?mol水蒸气,在相同条件下达到新的平衡时二氧化碳的体积分数减小
CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6?mol二氧化碳,再加入2?mol水蒸气,在相同条件下达到新的平衡时二氧化碳的体积分数减小
3、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)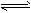 CH3CH2OH(g)+3H2O(g) 下列叙述错误的是 [???? ]
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是 [???? ]
A.反应需在300℃进行可推测该反应是吸热反应
B.使用Cu-Zn-Fe催化剂可大大提高生产效率
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
4、选择题 某兴趣小组为探究温度、压强对可逆反应A(g)+B(g)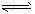 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各成分的浓度为[浓度2]、[浓度3]。

请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是[???? ]
A.由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应
B.由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度
C.[浓度1]中a=0.05mol/L
D.该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1] 比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差。
5、选择题 在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)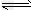 CH3OH(g) ΔH<0.第2?min时只改变一个条件,反应情况如下表
CH3OH(g) ΔH<0.第2?min时只改变一个条件,反应情况如下表

下列说法不正确的是[???? ]
A.第4?min至第6?min该化学反应处于平衡状态
B.第2?min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2?min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6?min时,其他条件不变,如果升高温度,正反应速率增大