微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向50mL 18mol/L的硫酸中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量[???? ]
A.小于0.45mol
B.等于0.45mol
C.在0.45mol 和0.9mol之间
D.等于0.9mol
参考答案:A
本题解析:
本题难度:一般
2、填空题 铬是水体的主要污染物之一,可以导致水生生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下

(1)在上图所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式
_____________________
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸溶液,可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是____________(写化学式);
(3)铬的化合价除了示意图中涉及的+3和+6价外,还有0,+2,+4和+5价等。现有24 mL浓度为0.05mol/L的Na2SO3溶液恰好与20 mL浓度为 0. 02 mol/L的Na2Cr2O7溶液完全反应。已知Na2SO3被Na2Cr2O7氧化为
Na2SO4,则元素Cr在还原产物中的化合价为___________;
(4)已知298 K时,Cr(OH)3的溶度积常数Ksp=6.3×10-31(mol/L)4,取少量Cr2(SO4)3溶液,加入一定量的氨水达到沉淀溶解平衡,测得pH=11,则此温度下残留在溶液中Cr3+的浓度为__________mol/L。
参考答案:(1)Cr2O72-+8H++3H2O2=2Cr3++3O2
本题解析:
本题难度:一般
3、选择题 将m1?g锌加到m2?g?20%?HCl溶液中去,反应结果共放出n?L氢气(在标准状况下),则被还原的HCl的物质的量是( )
A.
m1
65
mol
B.5m2
36.5
mol
C.m2
36.5
mol
D.n
11.2
mol
参考答案:D
本题解析:
本题难度:简单
4、简答题 反应2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是______,还原剂是______,若生成71gCl2,被氧化的HCl是______g.
参考答案:反应中Mn元素化合价降低,Cl元素化合价升高,则KMnO4为
本题解析:
本题难度:一般
5、选择题 将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体.再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀.根据题意推断气体x的成分可能是
A.0.3mol?NO2?和0.3mol?NO
B.0.2mol?NO2和0.1mol?N2O4
C.0.1mol?NO、0.2mol?NO2和0.05mol?N2O4
D.0.6mol?NO
参考答案:C
本题解析:分析:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为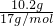 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断. =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
解答:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为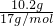 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol, =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
A、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故A错误;
B、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,
故B错误;
C、生成0.1mol NO、0.2mol NO2和0.05mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.05mol×2×(5-4)=0.6mol,得失电子相等,故C正确;
D、生成0.6molNO,N元素获得电子为0.6mol×(5-2)=1.8mol,故D错误.
故选:C.
点评:考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|