微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A.0.1mol
B.0.5mol
C.0.15mol
D.0.25mol
参考答案:B
本题解析:由电荷守恒:1.5mol×1+0.5mol×2=1.5mol×1+n(SO42-)×2, n(SO42-)=0.5mol,选B。
本题难度:一般
2、选择题 将标准状况下的aL HCl(g)溶于1 000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
[???? ]
A. mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C. mol·L-1
mol·L-1
D. mol·L-1
mol·L-1
参考答案:D
本题解析:
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,32gO2和O3的混合气体所含原子数为2NA
C.在常温常压下,44gCO2含有的原子数为3NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
参考答案:BC
本题解析:
试题分析:A、氦气为单原子分子,一个原子就组成一个分子,故含有NA个氦原子的氦气的物质的量为1mol,在标准状况下的体积约为22.4L,错误;B、O2和O3都由O构成,而O的摩尔质量为16g/mol,故32g O2和O3的混合气体所含原子的物质的量为2mol,原子数为2NA,正确;C、在常温常压下,44gCO2的物质的量为1mol,一个含有CO2含有3个原子,故所含原子数为3NA,正确;D、标准状况下,H2O为液体或固体,错误;故选BC。
考点:考查阿伏伽德罗常数的应用。
本题难度:一般
4、选择题 将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A.66.4 g
B.50.8 g
C.44.8g
D.39.2g
参考答案:B
本题解析:
试题分析:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),所以金属铝的质量是5.4g,金属铝失电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共失去电子的物质的量为 ×3=1.8mol,向反应后的溶液中加入过
×3=1.8mol,向反应后的溶液中加入过
本题难度:一般
5、计算题 (6分)用31.6g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸,反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
⑴该盐酸的物质的量浓度为 ?
⑵有 mol HCl被氧化?
⑶产生的Cl 2在标准状况下的体积为 ?
参考答案:(1)11.9mol/L
本题解析:考查物质的量的有关计算。
(1)根据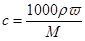 可知,盐酸的浓度是
可知,盐酸的浓度是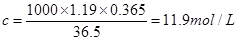 。
。
(2)31.6g KMnO4的物质的量是31.6g÷158g/mol=0.2mol,得到0.2mol×5=1.0mol电子。氯元素的化合价从-1价升高到0价,所以被氧化的盐酸的物质的量是1mol。
(3)根据方程式可知生成氯气的物质的量是0.5mol,所以在标准状况下的体积是0.5mol×22.4L/mol=11.2L。
本题难度:一般