微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CaCO3在下列哪种溶液中,溶解度最大???????????? (??? )
A.H2O
B.Na2CO3溶液
C.CaCl2溶液
D.乙醇
参考答案:A
本题解析:本题考查同离子效应对沉淀溶解平衡的影响问题,B、C两个选项都是由于同离子效应,使CaCO3的溶解平衡向左移动,溶解度减小。而D CaCO3选项在乙醇中是不能溶解的。因此应选A。
本题难度:简单
2、填空题 (14分)钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
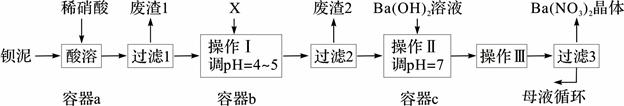
已知:i Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
参考答案:(1)BaSO4(s)+CO32-(aq) ![]()
本题解析:
试题分析:(1)在溶液中存在平衡:BaSO4(s)+CO32-(aq) 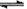 BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3(2分);(4)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(5)mg沉淀应该是硫酸钡,则碳酸钡的质量是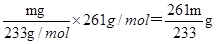 ,所以其纯度为
,所以其纯度为 ×100%。
×100%。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)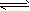 Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是[???? ]
Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是[???? ]
A.加MgCl2
B.加H2O
C.加NaOH
D.加HCl
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[???? ]
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
参考答案:D
本题解析:
本题难度:简单
5、填空题 (1)100℃时纯水Kw=1×10-12?mol2?L-2在该温度下,将1mL?0.001mol?L-1的NaOH溶液的pH为______,若加水稀释至100L,则溶液的pH为______.
(2)室温下,pH=1的稀硫酸a?L与pH=12的苛性钠b?L混合后溶液的pH=2,忽略溶液混合前后体积变化,则a:b=______.
(3)已知25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下Ca(OH)2离子积为Ksp=______.
参考答案:(1)1mL?0.001mol?L-1的NaOH溶液的c(O
本题解析:
本题难度:一般