微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)盐酸常用于清除金属表面的铜锈铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1. 0
| 3. 0
|
Fe2+
| 5. 8
| 8. 8
|
Cu2+
| 4.2
| 6.7
(1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]=
(2)根据上述数据该同学设计了以下实验流程:
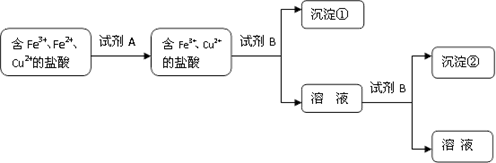
A可能是 ;试剂B的化学式是 ;沉淀②化学式是 。
参考答案:(共9分):(1)1.0×10-38(3分)
(2)双
本题解析:
试题分析:(1)根据表格的数据可知Fe3+沉淀完全的溶液的pH="3." 0, c(OH-)=10-11,离子浓度降至1×10-5 mol·L-1为沉淀完全,则ksp[Fe(OH)3]=c(Fe3+)?c3(OH-)=1×10-5×(10-11)3=1×10-38; (2)向含有Fe3+、Fe2+、Cu2+的盐酸溶液中加入双氧水等氧化剂,会把Fe2+氧化为Fe3+,得到含有Fe3+、Cu2+的盐酸溶液,然后向该溶液中加入NaOH溶液,调整溶液的pH=4,这时首先得到Fe(OH)3沉淀,过滤,得到的滤液中再加入NaOH只溶液的pH≥6.7,溶液中的Cu2+就会形成Cu(OH)2沉淀,因此沉淀②是Cu(OH)2。
考点:考查沉淀溶解平衡常数的计算、溶液中杂质离子除去的试剂的选择、沉淀的成分的确定的知识。
本题难度:困难
2、选择题 下列有关实验操作、现象和结论都正确的是[???? ]
操作
现象
结论
A.
向某溶液中滴加氯水和CCl4,震荡,静置
下层溶液显紫色
原溶液中只有I-
B.
向NaI溶液中先滴加少了AgNO3溶液,后滴加少量Na2S溶液
先有黄色沉淀后变成黑色沉淀
Ksp(Ag2S)比Ksp(AgI)大
C.
将SO2通入溴水中
溴水褪色
SO2具有漂白性
D.
向淀粉溶液中滴加稀硫酸,加热,取出水解液少许,滴加银氨溶液,并水浴加热
没有银镜出现
淀粉没有发生水解
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好
参考答案:A.只有具有相同结构的难溶物(如AgCl、AgBr、AgI)
本题解析:
本题难度:简单
4、选择题 对“ ”的理解正确的是(??? )。 ”的理解正确的是(??? )。
A.说明AgCl没有完全电离,AgCl是弱电解质
B.说明溶解的AgCl已完全电离,AgCl是强电解质
C.说明Ag+与Cl-的反应不能完全进行到底
D.说明Ag+与Cl-的反应可以完全进行到底
参考答案:C
本题解析:
试题分析:  ,该方程式表示AgCl的溶解平衡,溶解平衡的含义就是离子结合成沉淀的速率等于沉淀电离成离子的速率,所以说明Ag+与Cl-的反应不能完全进行到底,答案选C。 ,该方程式表示AgCl的溶解平衡,溶解平衡的含义就是离子结合成沉淀的速率等于沉淀电离成离子的速率,所以说明Ag+与Cl-的反应不能完全进行到底,答案选C。
本题难度:一般
5、计算题 硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为
200mL。计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200mol/L?
参考答案:(1)c(Ag+)=![]() 本题解析: 本题解析:
本题难度:一般
|