微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中既含离子键又含共价键的是
A.硫酸
B.氯化镁
C.氢氧化钡
D.二氧化碳
参考答案:C
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。所以A~D中含有的化学键分别是极性键、离子键、离子键和极性键、极性键,因此答案选C。
本题难度:一般
2、计算题 PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)??H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)???H = -566.0 kJ/mol?????
H2O(g)=H2O(1)??H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
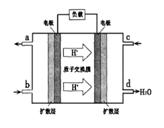
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。

(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
参考答案:(16分)
(1)?①CH3OH(l)+O2(g)=
本题解析:
试题分析:
(1)①根据盖斯定律①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)?△H=-442.8kJ·mol-1。②结合图像电池中质子移向正极,O2在正极反应。应从c通入,发生O2+4e-+4H+=2H2O,所以负极为CH3OH+ H2O-6e-=CO2↑+6H+。③溶液的pH=8应为溶质为碳酸氢钠,离子浓度由大到小的顺序是c(Na+)> c(HCO- 3)> c(OH-)> c(H+)> c(CO2- 3)。
(2)达到平衡状态
本题难度:一般
3、选择题 下列变化中,属于放热反应的是
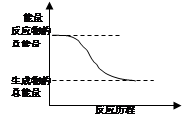
A.H2O(g)==H2O(l)△H= -44kJ/mol
B.2HI(g)==H2(g)+I2(g)△H=+14.9kJ/mol
C.能量变化如右图所示的化学反应
D.形成化学键时放出能量的化学反应
参考答案:C
本题解析:
试题分析:物质液化时需放热,但不是化学反应,A错误;△H=+14.9kJ/mol,该反应为吸热反应,B错误;因反应物的能量高于生成物的能量时,反应是放热反应,C正确;断裂化学键时吸收的能量大于形成化学键共放出的热量,则反应为吸热反应,反之反应为放热反应,D错误,选C.
考点:考查放热反应的概念、特征。
本题难度:一般
4、选择题 在无色透明溶液中,能够大量共存的离子组是
A.I-、ClO-、K+、H+
B.Na+、Cu2+、Cl-、SO42-
C.H+、Ca2+、Cl-、CO32-
D.Na+、Cl-、NO3-、CO32-
参考答案:D
本题解析:分析:溶液无色透明,则有颜色的离子不能大量存在,如离子之间不发生任何反应,则可大量共存.
解答:A.溶液无色,但ClO-与H+生成弱电解质HClO而不能大量共存,且ClO-与I-发生氧化还原反应,故A错误;
B.Cu2+有颜色,不符合题意,故B错误;
C.CO32-与H+反应生成二氧化碳气体而不能共存,且CO32-与Ca2+反应沉淀,故C错误;
D.四种离子无色,且离子之间不发生任何反应,能大量存在,故D正确.
故选D.
点评:本题考查离子共存问题,题目难度不大,本题注意常见有颜色的离子的种类,注意离子反应的类型以及离子的性质.
本题难度:简单
5、选择题 下列叙述正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.在8NH3+3Cl2═N2+6NH4Cl反应中,氧化剂与还原剂物质的量之比是2:3
D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-═2Fe2++Br2不易进行
参考答案:D
本题解析:分析:A、从元素最高价可以具有氧化性,具有最低价具有还原性分析;
B、依据氧化还原反应的特征分析,与元素化合价的变化有关,只要是有元素化合价降低,就可以做氧化剂;
C、标注化合价,分析氧化剂和还原剂的物质的量;
D、从氧化还原反应中遵循强弱规律,还原剂的还原性大于还原产物分析判断;
解答:A、阳离子中间价态即具有氧化性也具有还原性,阴离子可以有还原性,也可以有氧化性,故A错误;
B、含氧酸可作氧化剂,而无氧酸也可以做氧化剂如盐酸与金属反应,故B错误;
C、在8NH3+3Cl2═N2+6NH4Cl反应中,氧化剂为氯气,还原剂为氨气,标注化合价判断,氧化剂氯气3mol化合价变化反应,还原剂NH32mol化合价变化反应,所以氧化剂与还原剂物质的量之比是3:2,故C错误;
D、已知还原性:Fe2+>Br-,依据还原剂的还原性大于还原产物,可知反应2Fe3++2Br-═2Fe2++Br2,不符合还原性强弱,所以不易进行,故D正确;
故选D.
点评:本题考查了根据化合价变化判断氧化还原反应的各种概念的关系,氧化还原反应的定量计算方法,反应能否进行的判断依据.
本题难度:简单