微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是常温常压下能使湿润红色石蕊试纸变蓝色的气体;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图 ,G的化学式是 。
(2)比较BC和EC2的碱性强弱BC EC2(填< 、> 、=" " )。
(3)F与C反应生成D的离子方程式 。
参考答案:
(1)H2O (2)![]()
本题解析:
本题难度:一般
2、选择题 下列离子方程式正确的是
A.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
B.将少量Cl2通入FeI2溶液中:2Fe2++Cl2===2Cl-+2Fe3+
C.将大理石投入到足量盐酸中:CO32-+2H+===CO2↑+H2O
D.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O
参考答案:D
本题解析:
试题分析:A.向NaAlO2溶液中通入过量CO2生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3—,A错误;B.碘离子的还原性强于亚铁离子,因此将少量Cl2通入FeI2溶液中只氧化碘离子,即2I-+Cl2=2Cl-+I2,B错误;C.大理石不溶于水,则将大理石投入到足量盐酸中反应的离子方程式为CaCO3+2H+=CO2↑+H2O+Ca2+,C错误;D.硝酸甲乙强氧化性,则Fe3O4与足量稀HNO3反应的离子方程式为3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O,D正确,答案选D。
考点:考查离子方程式正误判段
本题难度:一般
3、实验题 选考【化学——选修2:化学与技术】(15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
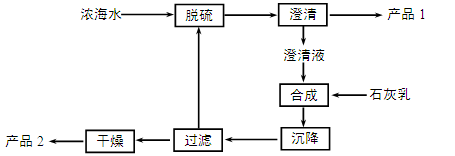
浓海水的主要成分如下:
离子
| Na+
| Mg2+
| Cl-
| SO42-
|
浓度/(g·L-1)
| 63.7
| 28.8
| 144.6
| 46.4
该工艺过程中,脱硫阶段主要反应的阳离子_____,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
参考答案:(1)②③④ (3分)(2)3Br2+6CO32-
本题解析:
试题分析:(1)①用混凝法获取淡水利用的是胶体的吸附性,不能用于大规模海水淡化,①错误;②提高部分产品的质量、③优化提取产品的品种、④改进钾、溴、镁等的提取工艺均有利于改进和优化海水综合利用工艺的设想和做法,答案选②③④。
(2)Br2与纯碱反应溴歧化为Br-和BrO3-,当并没有产生CO2,这说明反应中有碳酸氢钠产生,因此反应的离子反应方程式为3Br2+6CO32-+3H2O=Br-+BrO3—+6HCO3—。
(3)石灰乳中的钙离子与硫酸根结合生成硫酸钙沉淀,因此该工艺过程中,脱硫阶段主要反应的阳离子Ca2+;石灰乳中的氢氧根离子结合镁离子生成氢氧化镁沉淀,因此获得产品2的离子反应方程式为 Mg2++2OH-=Mg(OH)2↓;浓海水的利用率为90%,则1L浓海水最多可得到氢氧化镁的质量为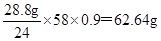 。 。
(4)由于氯化镁在溶液中水解生成氢氧化镁和氯化氢,且水解吸热,所以由MgCl2·6H2O制备MgCl2时,需要在HCl的气体氛围中加热以及抑制MgCl2水解。
考点:考查海水综合应用的分析与判断
本题难度:困难
4、填空题 (9分)(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 。
(3)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是________(填字母)。
A.铜粉 B.氯气 C.铁粉 D.KSCN溶液
(4)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是____nm,区别该液体和FeCl3溶液可用 方法。
参考答案:(1) Fe2+ C&#
本题解析:
试题解析:(1)铁离子Fe3+,可以在溶液中加入硫氰酸钾溶液,溶液变为血红色,证明是含有三价铁离子;某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为血红色,说明原溶液含有亚铁离子,加入氯水发生反2Fe2++Cl2=2Fe3++2Cl-,生成的铁离子和硫氰酸根离子生成血红色溶液;要除去FeCl3溶液中少量的氯化亚铁,可行的办法是加入氧化剂,但不引入新的杂质,即通入氯气,对应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,对应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+;(3)从使用过的腐蚀液中含铜离子,回收铜,可利用金属单质之间的置换反应,选项中只有铁粉能置换出Cu;(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,生成氢氧化铁胶体,胶体的微粒直径的范围是1~100nm,区分胶体和FeCl3溶液可以通过丁达尔现象(效应),氢氧化铁胶体具有光亮的通路。
考点:铁及其化合物的性质
本题难度:一般
5、填空题 (12分)Ⅰ.将下列离子Na+、K+、Cu2+、H+、NO3
参考答案:
本题解析:
本题难度:一般
|