微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是
A.放电时,OH-向负极方向移动
B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O
C.充电时,Zn发生氧化反应
D.充电时,阴极反应为O2+2H2O+4e-=4OH-
2、选择题 铅蓄电池属于二次电池。下图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。电池反应为:Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
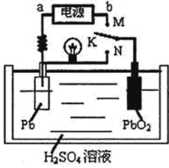
下列有关说法正确的是
A.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得氯气2.24L,则电池内消耗的H2SO4的物质的量是0.2mol
B.K与N相接时,H+向正极区迁移
C.K与M连接时,所用电源的b极为负极
D.K与M相接时,阳极附近的pH逐渐增大
3、选择题 下列与金属腐蚀有关的说法正确的是
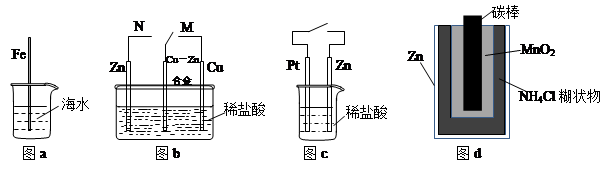
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
4、实验题 “阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水,使用一段时间后Fe粉会变质。某校化学兴趣小组欲探究使用过的 “脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了???????腐蚀,生成的铁锈主要成分是????????(填化学式);
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是?????????;
步骤 ⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0?g。据此计算8.0?g滤渣中活性炭的质量为???????????????;
⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0?g。据此计算8.0?g滤渣中活性炭的质量为???????????????;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于??????????mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热 ,冷却、称量,得到6.86g固体。
,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉的变质程度为??????????????????????????。
5、选择题 下图是一种航天器能量储存系统原理示意图。下列说法正确的是
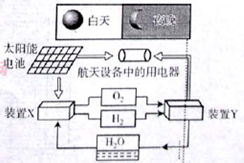
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e—=4OH—
C.装置X能实现燃料电池的燃料和氧化剂再生
D.该系统能实现物质的零排放,并能实现化学能与电能间的完全转化