微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失 水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
(1)负极______????????????????????????????????????????????;
(2)正极_____???????????????? ?????????????????????????????;
?????????????????????????????;
(3)离子方程式______??????????????????????????????????????;
(4)化学方程式______???????????????????????????????????????.
参考答案:(12分,每空3分)
(1) 2Fe-4e-=2Fe2
本题解析:略
本题难度:简单
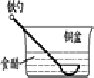
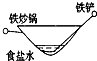
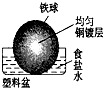
2、选择题 相同材质的铁在下列情形下最不易被腐蚀的是( )
A.
B.
C.
D.
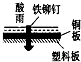
参考答案:A、铁做负极、铜做正极,食醋为电解质溶液,形成原电池,铁发生
本题解析:
本题难度:一般
3、选择题 金属及其制品在腐蚀介质中很容易被腐蚀,使其使用寿命大为降低。因此只有对腐蚀介质中的金属及其制品采取防护措施,才能保证金属工艺设备的安全性。下面对金属及其制品的防护措施中错误的是 [???? ]
A.铁锅用完后,用水刷去其表面的油污,置于潮湿处保存
B.通过特殊工艺,增加铝制品表面的氧化膜
C.对于易生锈的铁制品(如防护网)要定期涂刷防护漆
D.把Cr、Ni等金属加入到普通钢里制成不锈钢
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列说法正确的是 [???? ]
A.?葡萄糖在人体内的反应既属于氧化还原反应又属于吸热反应 ??
B.?钢铁易生锈被腐蚀,而铝、铜等金属不容易被腐蚀,是因为铁的活泼性强 ??
C.?氢燃料电池把氨气和氧气燃烧放出的热能转化为电能 ??
D.?在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率
参考答案:D
本题解析:
本题难度:简单
5、简答题 (16分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是??????????????。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______?__??????????????????。
(3)写出反应④生成沉淀X的离子方程式:
???????????????????????????????????????????。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
???????????????????????????????????????????。
(5)生成Li2CO3的化学反应方程式为______????????????????????????????__。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_?????????_。
参考答案:(1)增大接触面积,加快反应速率(2分)
(2)隔绝空
本题解析:(1)进行粉碎操作可以增大反应物的接触面积,加快反应速率。
(2)锂是活泼的金属,极易和水及氧气反应,所以需要隔绝空气和水分。
(3)滤液中含有偏铝酸钠,所以通入CO2能生成氢氧化铝沉淀,方程式为CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–。
(4)LiMn2O4中Mn的化合价为+3和+4价,则+3价的被氧化生成二氧化锰,方程式为4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O。
(5)Li2CO3的溶解度小于硫酸锂的,因此硫酸锂和碳酸钠反应可以生
本题难度:一般