微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列晶体或分子中,含有化学键类型有差异的一组是
A.NH3、NO2。
B.NaCl、KF
C.NaOH、Ca(OH)2
D.MgO、H2O2
参考答案:D
本题解析:
试题分析:A. NH3、NO2都是由极性共价键构成的极性分子。错误。B.NaCl和KF都是由离子键构成的离子晶体。错误。C. 在NaOH和Ca(OH)2中含有离子键、极性共价键,属于离子晶体。错误。D.MgO是离子化合物,含有离子键; H2O2??????是共价化合物,含有极性共价键、非极性共价键。含有化学键类型有差异。正确。
本题难度:一般
2、选择题 下列关于化学键的说法中正确的是
A.化学键是一种静电引力
B.化学键可以使离子结合,也可以使原子结合
C.只要有旧健的断裂就一定是化学反应
D.氢键是一种化学键
参考答案:B
本题解析:
试题分析:化学键是使原子或离子相结合的强烈作用力,B正确,A不正确;旧健的断裂,同时还有新的化学键形成,才是化学反应,C不正确。氢键不是化学键,D不正确,答案选B。
点评:该题是基础性试题的考查,难度不大。该题主要是考查学生对化学键概念的熟悉掌握程度,以及灵活运用化学键解决实际问题的能力。
本题难度:简单
3、选择题 已知反应:① 2C(s)+O2(g)=2CO(g)?????? ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l)?? ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
参考答案:A
本题解析:
试题分析:在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,C的燃烧生成的稳定的氧化物为二氧化碳,而有CO转化为CO2,是放热反应,所以碳的燃烧热大于110.5 kJ/mol,故A正确;B错误,①的反应热为-221 kJ/mol, C错误,稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol,D错误,因为稀醋酸为弱电解质,反应过程中要发生电离,所以放出的热量小于57.3 kJ。
点评:本题考查了燃烧热、反应热、中和热的基础知识,是高
本题难度:一般
4、填空题 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。
请认真观察下图,然后回答问题。
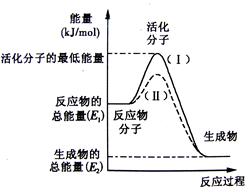
(1)图中所示反应是 (填“吸热”或“放热”)反应,引发该反应时 (填“需要”或“不需要”)加热,该反应的热效应的绝对值为
(用含E1、E2的代数式表示)。
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应的活化能为_____kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。
参考答案:(1)放热;需要,|E1-E2|;(2)409;(3)使用催
本题解析:
试题分析:(1)图中所示反应物能量关于生成物能量,故反应是放热反应,因为活化分子能量高于反应物,故引发该反应时需要加热,该反应的热效应的绝对值为|E1-E2|或|E2-E1|;
(2)已知反应:H2(g)+1/2 O2(g)=H2O(g)的热效应为为241.8 kJ·mol-1,则其逆反应H2O(g)=H2(g)+1/2 O2(g)的活化能为反应热的绝对值+正反应的活化能kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,加入了催化剂,活化能大大降低,活化分子百分数增多,反应速率加快。
考点:活化分子理论图像解说。
本题难度:一般
5、选择题 下列各组化合物中化学键类型不同的是( )
A.NaCl和HNO3
B.H2O和NH3
C.MgF2和NaCl
D.H2O和CO2
参考答案:A、NaCl为离子化合物且只含有离子键,而HNO3为共价化合
本题解析:
本题难度:简单