微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
参考答案:C
本题解析:
试题分析:A.热化学方程式中,化学式前面的化学计量数只表示物质的量,错误;B.热化学方程式中,如果没有注明温度和压强,则表示在通常状况下测得的数据,错误;C.由于物质的能量与物质的多少、聚集状态等有关,所以书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态,正确;D.大多数化合反应是放热反应,分解反应是吸热反应,但是也有例外,如氢气与碘蒸气产生HI的化合反应是吸热反应;KClO3分解产生KCl和O2的反应是分解反应,也是放热反应,错误。
考点:考查化学反应和化学方程式的书写应该注意的问题的知识。
本题难度:一般
2、填空题 红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
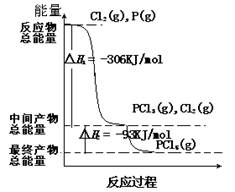
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
参考答案:(每空2分)
(1)P(s) + 3/2 Cl2(g)
本题解析:
试题分析:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H="-306" kJ/mol,热化学方程式为:P(s)+3/2Cl2(g)
本题难度:一般
3、选择题 CO(g)与H2O(g)反应过程的能量变化如下图所示,有关两者反应说法正确的是( )

A.该反应为吸热反应
B.CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)具有的总能量
C.反应的热化学方程式:CO(g)+H2O(g)===CO2(g)+H2(g);ΔH=+41kJ·mol-1
D.1mol CO2(g)和1mol H2(g)反应生成1mol CO(g)和H2O(g)要放出41kJ的热量
参考答案:B
本题解析:
试题分析:从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,从反应热为“-”也可知此反应为放热反应,故A错误,B正确;从图示可知,正反应为放热反应,正确的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)??△H=-41kJ/mol,故C、D错误,答案选D。
点评:该题的关键是明确反应热的表示方法、热化学反应方程式的书写,要明确正逆反应的反应热大小相等,符号相反等,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
4、选择题 下列与化学反应能量变化相关的叙述正确的是( )
A.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
参考答案:D
本题解析:
试题分析:A、NaOH溶于水放热,所以则向含0.1molHCl的盐酸中加入4.0gNaOH固体,放出热量大于5.73kJ,故A错误;B、氢气和氧气反应生成液态水比生成水蒸气放热多,故B错误;C、反应热的大小与反应条件无关,所以同温同压下氢气和氯气载光照和点燃条件下焓变相同,故C错误;D、一个化学反应与其逆反应的反应热数值相同,符号不同,故D正确。
考点:本题考查化学反应与能量转化。
本题难度:一般
5、选择题 下列说法不正确的是
A.乙烯、苯、溴苯分子中的所有原子均共平面
B.水加热至1000℃以上才分解是因为水分子间存在着氢键
C.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸
D.能发生银镜反应的有机物结构中一定含有-CHO
参考答案:B
本题解析:
试题分析:氢键是一种特殊的分子间作用力,非化学键,只影响物质的物理性质,如熔点、沸点,不影响化学性质,水在高温下难分解是化学性质,故B错误。
本题难度:一般