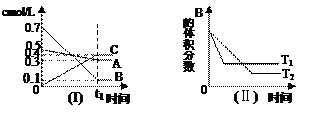
?
A.该平衡体系的化学方程式为:A(g)+3B(g) 2C(g) 2C(g)
B.(t1+10)min时,保持容积总压强不变,通入稀有气体,平衡向逆反应方向移动
C.在t1时间内使用B表示该反应的平均速率为3/5 t1mol/(L·min)
D.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
参考答案:D
本题解析:根据图I推出反应方程式,据图Ⅱ知该正反应为放热反应。温度升高,平衡逆向移动,A的转化率减小
本题难度:简单
2、计算题 在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3amol。此时,NH3的物质的量分数是________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol,?????????(选填“>”、“<”或“=”)。
参考答案:(6分,每空2分)(1) a /(7-a
本题解析:(1)生成NH3amol,则根据方程式可知,消耗氮气和氢气分别是0.5amol和1.5amol,则剩余氮气和氢气分别是(3-0.5a)mol、(4-1.5a)mol,所以氨气的体积分数是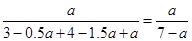 。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。 。增大氮气的浓度,平衡向正反应方向移动,但氮气的转化率降低,所以氮气的含量增大。
(2) 若起始时,向乙中通入6mol N2和8mol H2,则乙相当于在甲的基础上增大氧气,平衡向正反应方向移动,所以b大于2a,即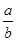 < <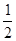 。 。
本题难度:一般
3、选择题 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  ?Y(g)+Z(s),以下能说明反应达到平衡标志的是 ?Y(g)+Z(s),以下能说明反应达到平衡标志的是
A.混合气体的压强不再变化
B.X、Y、Z的物质的量之比为2:1:1
C.单位时间内生成lmolY的同时分解2mol X
D.X的分解速率与Y的消耗速率相等
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系所以B不正确。根据方程式可知,反应前后体积是变化的,所以压强也是变化的,因此A正确。C中反应速率的方向相同,不能说明。D中反应速率的方向相反,但不满足反应速率之比是相应但化学计量数之比,不正确。答案选A。
本题难度:简单
4、选择题 某温度下,对于反应N2(g)+3H2(g) 2NH3(g)???△H=-92.4kJ/mol。 2NH3(g)???△H=-92.4kJ/mol。
 N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是: N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是:
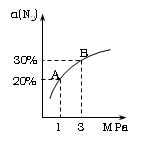
A. 将1.0mol氮气、3.0mol氢气,置 于1L密闭容器中 于1L密闭容器中
发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) < K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应 速率增大,正反应速率减小。 速率增大,正反应速率减小。
参考答案:C
本题解析:略
本题难度:简单
5、选择题 在平衡体系2NO+O2 ?2NO2中通入18O组成的氧气,重新达到平衡后,则18O ?2NO2中通入18O组成的氧气,重新达到平衡后,则18O
A.只存在于O2中
B.只存在于NO2中
C.只存在于O2和NO2中
D.存在于NO、O2、NO2
参考答案:D
本题解析:
试题分析:2NO+O2 ?2NO2这个反应是可逆反应,在18O2投入后,在正逆反应的过程中,使得18O存在于NO、O2、NO2中。 ?2NO2这个反应是可逆反应,在18O2投入后,在正逆反应的过程中,使得18O存在于NO、O2、NO2中。
本题难度:简单
|