微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关铁元素的叙述中正确的是( )
A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:
Fe(OH)2<Fe(OH)3
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D.铁元素位于周期表的第四周期第ⅧB族
参考答案:A
本题解析:I2的氧化性较弱,铁与I2反应生成FeI2,B错;氢氧化铁与氢碘酸发生氧化还原反应:2Fe(OH)3+6HI=2FeI2+I2+6H2O,C错;铁元素位于周期表的第四周期第Ⅷ族,D错。
本题难度:简单
2、选择题 下列关于物质性质的叙述中,正确的是[???? ]
A.SO2的水溶液具有酸性、氧化性、还原性和漂白性
B.石灰石、高岭石、石英和水晶的主要成份都是硅酸盐
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe2+
D.硅是应用广泛的半导体材料,常温下易与氧气、氯气、硫酸等物质反应
参考答案:AC
本题解析:
本题难度:一般
3、实验题 (10分)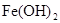 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用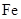 ,
,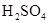 (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取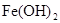 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.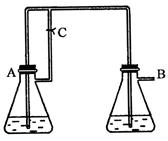
参考答案:铁和稀硫酸 氢氧化钠溶液
①打开弹簧夹C;A中气体由导
本题解析:要产生还原性的气体,应该用铁和稀硝酸反应生成氢气。即A中的试剂是铁和稀硫酸。利用生成的氢气排尽装置中的空气,从而可以防止氢氧化亚铁被氧化。最后利用氢气产生的越强将硫酸亚铁压入氢氧化钠中进行反应,所以B中的试剂是氢氧化钠溶液。具体的操作是①打开弹簧夹C;A中气体由导管进入B,B中有 气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛。
②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A
中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(O
本题难度:一般
4、选择题 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是
[???? ]
A.①③
B.③④
C.①②
D.①③④
参考答案:A
本题解析:
本题难度:简单
5、选择题 将铜片投入到稀硫酸中,铜片不溶,再加入下列试剂后,可使铜片溶解的是(???? )
A.稀盐酸
B.硫酸钠晶体
C.硝酸钠晶体
D.氯化铁晶体
参考答案:CD
本题解析:稀盐酸不能溶解铜,硫酸钠也不能溶解铜。在酸性溶液中,硝酸盐具有强氧化性,能把铜氧化,而硝酸则被还原生成NO,C正确。氯化铁中的铁离子能把铜氧化生成铜离子和亚铁离子,D正确。所以答案选CD。
本题难度:一般