微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
有关铜与浓硝酸反应的说法中,下列不正确的是( ? )
A.HNO3是氧化剂,NO2是还原产物
B.若2mol HNO3被还原,则反应中一定生成22.4L NO2气体
C.参加反应的硝酸中,被还原和未被还原硝酸的物质的量比是1:1
D.硝酸在反应中既表现了强氧化性,又表现了酸性
参考答案:C
本题解析:
本题难度:一般
2、填空题 (6分)用化学用语填空:
(1)原子核内有8个质子和10个中子,则表示该核素的符号为??????????
(2)二氧化碳的结构式______________ 。
(3)用石墨电极电解饱和食盐水的阳极的电极反应式???????????????????????????。
(4)钢铁发生吸氧腐蚀时正极的电极反应式????????????????????????????????。
参考答案:(6分)(1) 本题解析:略
本题解析:略
本题难度:一般
3、填空题 “氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。
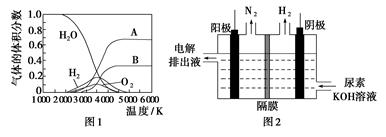
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
参考答案:(1)CH4(g)+2H2O(g)=CO2(g)+4H2(g
本题解析:(1)根据盖斯定律将第一个热化学方程式扩大两倍再减去第二个热化学方程式即得该热化学方程式,ΔH也进行相应的计算得ΔH=206.2 kJ·mol-1×2-247.4 kJ·mol-1=165.0 kJ·mol-1。
(2)硫化氢燃烧放热,为其分解提供能量。硫化氢和二氧化硫反应生成单质硫和水。
(3)1 mol H2O分解首先得到2 mol H和1 mol O,故曲线A为H,曲线B为O。
(4)根据装置图可知阳极产生了N2,阴极产生了H2,再分析元素化合价的升降,可知阴极H+得电子生成氢气,
本题难度:困难
4、选择题 下列反应中不属于氧化还原反应的是

A.2H2O2 2H2O+O2
2H2O+O2 ↑
↑
B.2Na+2H2O=2NaOH+H2↑

C.CaO+SiO2 CaSiO3
CaSiO3
D.2KI+Cl2=2KCl+I2
参考答案:C
本题解析:略
本题难度:一般
5、选择题 用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物
中的化合价是
A.+4
B.+3
C.+2
D.+1
参考答案:A
本题解析:
试题分析:Na2SO3被氧化成硫酸钠,所以0.1 mol/L×0.03L的Na2SO3失电子的物质的量为0.1 mol/L×0.03L×2=0.006mol,XO4-中X的化合价是+7,设X在还原产物中的化合价是n,根据得失电子守恒,有0.006=2×10-3 mol×(7-n),解得n=4,答案选A。
考点:考查氧化还原反应中得失电子守恒规律的应用
本题难度:一般