微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作中,能使电离平衡H2O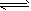 H++OH-向右移动且溶液呈酸性的是[???? ]
H++OH-向右移动且溶液呈酸性的是[???? ]
A. 向水中加入NaHSO4溶液
B. 向水中加入Al2(SO4)3固体
C. 向水中加入Na2CO3溶液
D. 将水加热到100℃,使pH=6
参考答案:B
本题解析:
本题难度:一般
2、选择题 25℃时,水的电离达到平衡:H2O 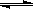 H++OH- ,下列叙述正确的是
H++OH- ,下列叙述正确的是
A. 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.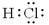 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时, 表示的微粒加入水中,促进水的电离,KW不变
表示的微粒加入水中,促进水的电离,KW不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
参考答案:C
本题解析:
试题分析: 为S2—,S2—会结合水电离的H+生成HS—,故S2—会影响水的电离,故A项错误;B.
为S2—,S2—会结合水电离的H+生成HS—,故S2—会影响水的电离,故A项错误;B. 表示的物质加入水中。HCl电离HCl= H++Cl—,故c(H+)增大,抑制水的电离,故B项错误;
表示的物质加入水中。HCl电离HCl= H++Cl—,故c(H+)增大,抑制水的电离,故B项错误; 为CH3COO—,CH3COO—会水解结合水电离的H+,促进水的电离,温度不变则KW不变,故C项正确;水的电离程度不但与温度有关,温度越高,电离程度越大,还与溶液中离子有关,H+、OH-会抑制水的电离,弱酸根或弱碱阳离子均会促进水的电离,故D项错误;本题选C。
为CH3COO—,CH3COO—会水解结合水电离的H+,促进水的电离,温度不变则KW不变,故C项正确;水的电离程度不但与温度有关,温度越高,电离程度越大,还与溶液中离子有关,H+、OH-会抑制水的电离,弱酸根或弱碱阳离子均会促进水的电离,故D项错误;本题选C。
考点:水的电离及影响因素。
本题难度:困难
3、简答题 已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25°C时,水的电离平衡曲线应为哪一条?请说明理由______
(2)95°C时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为为多少?
(3)95°C时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是?
(4)曲线B对应的温度下,pH=2的某酸HA与pH=10的NaOH溶液等体积混合后,溶液的pH=5,请分析其原因______.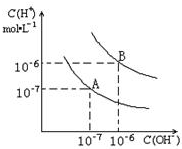
参考答案:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温
本题解析:
本题难度:一般
4、选择题 将纯水加热至较高温度,下列叙述正确的是 [???? ]
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列操作会使水的电离平衡向电离方向移动,且pH>7的是 [???? ]
A.将纯水加热到80℃
B.向水中加入少量的NH4Cl
C.向水中加入少量的NaHSO4固体
D.向水中加入少量的NaHCO3固体
参考答案:D
本题解析:
本题难度:一般