微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Cu、Cu2O和CuO组成的混合物,加入100 mL 0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224 mLNO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005mol<n(Cu)<0.015mol
参考答案:B
本题解析:
试题分析:A、100 mL 0.6mol/LHNO3溶液中硝酸的物质的量=0.1L×0.6mol/L=0.06mol。生成NO的物质的量=0.224L÷22.4L/mol=0.01mol,因此根据氮原子守恒可知,硝酸铜的物质的量=(0.06mol-0.01mol)÷2=0.025mol,A正确;B、若混合物中Cu的物质的量为0.005 mol,则根据铜原子守恒可知,Cu2O、CuO中铜原子的物质的量共计是0.025mol-0.005mol=0.02mol,因此Cu2O、CuO的物质的量一定小于0.
本题难度:一般
2、选择题 将50g浓度为18.4mol/L、密度为1.84g/cm3的某硫酸稀释成9.2mol/L的溶液.则加入水的体积(水的密度为1.0g/cm3)
A.小于50ml
B.等于50ml
C.大于50ml
D.等于ml
参考答案:A
本题解析:分析:令浓硫酸的体积为VmL,根据稀释定律计算稀释后溶液的体积,硫酸溶液的浓度越大密度越大,据此判断稀释后溶液的质量,进而判断加入水的质量,再根据V=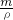 判断.
判断.
解答:令浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设稀释后溶液的体积为a,
则:VmL×18.4mol/L=a×9.2mol/L,解得a=2VmL,
硫酸溶液的浓度越大密度越大,所以稀释后硫酸的密度小于1.84g/cm3,故稀释后硫酸的质量小于100g,所以加入水的质量小于100g-50g=50g,
故加入水的体积小于 =50mL,
=50mL,
故选A.
点评:本题考查物质的量浓度的有关计算,难度中等,清楚硫酸溶液的浓度越大密度越大是解题关键.
本题难度:简单
3、选择题 设NA为阿伏加德罗常数,下列说法中正确的是
A.11.2L氢气一定含有NA个氢原子
B.18g水含有电子数为8NA
C.在通常情况下,1L1mol/L的氨水中含有分子数为NA
D.常温常压下,32g氧气(O2)和臭氧(O3)的混合气所含原子数为2NA
参考答案:D
本题解析:略
本题难度:简单
4、填空题 今欲用NaOH固体配制100mL0.5mol/L的NaOH溶液.配制过程如图所示:
请根据题意回答:
(1)配制该溶液应选用______(填仪器).
(2)用小烧杯在托盘天平上称取______NaOH固体.
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应______.
(4)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
(5)以下因素会造成实验结果偏低的是______(填序号)
a.容量瓶中原来有少量蒸馏水 b.定容时观察液面俯视
c.忘记洗涤d.定容时观察液面仰视.
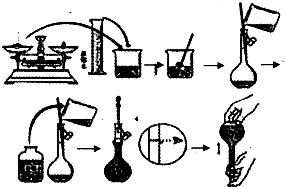
参考答案:(1)容量瓶的规格与溶液的体积一致,NaOH溶液的体积为10
本题解析:
本题难度:一般
5、简答题 现从固体KOH出发配制0.1mol/L的KOH溶液500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、______
(2)如果在定容时仰视操作,则所配得溶液的浓度______0.1mol/L(填>,=,<)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度______0.1mol/L(填>,=,<)
(4)若用250mL的H2SO4溶液恰好能将此500mL0.1mol/L的KOH溶液中和,则该硫酸的物质的量浓度为______mol/L.
参考答案:(1)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一
本题解析:
本题难度:一般