微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)已知?20mL?含有0.05mol/L的R2O72-溶液恰好能将20mL浓度为?0.3mol/L的Fe2+完全氧化,Fe2+转化成Fe3+,则元素R在还原产物中的化合价为______.
(2)用质量分数为98%,密度为1.8g?cm-3的浓硫酸配制1.0mol?L-1的稀硫酸500mL,计算所需浓硫酸的体积为______mL.(计算结果保留到小数点后一位)
参考答案:(1)n(R2O72-)=0.02L×0.05mol/L=0
本题解析:
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+ 离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1 NA
参考答案:A
本题解析:
试题解析:A、依据n= 计算物质的量=
计算物质的量=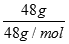 =1mol,结合臭氧分子式计算氧原子数3NA,故A正确;B、依据n=
=1mol,结合臭氧分子式计算氧原子数3NA,故A正确;B、依据n= 计算物质的量=
计算物质的量=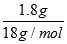 =0.1mol,结合铵根离子是10电子微粒计算含有的电子数为1NA,故B错误;C、结合气体摩尔体积概念分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;D、依据n=
=0.1mol,结合铵根离子是10电子微粒计算含有的电子数为1NA,故B错误;C、结合气体摩尔体积概念分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量不是0.5mol,故C错误;D、依据n= 计算物质的量=
计算物质的量= =0.1mol,结合镁原子最外层2个电子分析得到镁变为镁离子时失去的电子数为0.2NA,故D错误。
=0.1mol,结合镁原子最外层2个电子分析得到镁变为镁离子时失去的电子数为0.2NA,故D错误。
考点:阿伏加德罗常数
本题难度:一般
3、计算题 把300mL2.0 mol/L CuSO4溶液和l00 mL l.0 mol/LH2SO4溶液混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算
(1)混合溶液中CuSO4的物质的量浓度。
(2)混合溶液中Cu 2+、H+、SO42-的物质的量浓度。
参考答案:(1)1.5mol/L;(2)1.5mol/L、0.5mol
本题解析:考查根据化学方程式进行的有关计算。
(1)混合前硫酸铜的物质的量是0.3L×2.0mol/L=0.6mol
所以混合后CuSO4的物质的量浓度是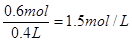
(2)混合前硫酸的物质的量是0.1L×1.0mol/L=0.1mol
所以混合后硫酸的物质的量浓度是 本题难度:一般
本题难度:一般
4、选择题 下列反应中,反应物的用量或浓度改变时,不会改变生成物的是(???)
A.铁与硫酸反应
B.氢氧化钠溶液和CO2反应
C.硫在氧气中燃烧
D.铜和与硝酸反应
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (2分) 12.4g Na2X中含Na+ 0.4mol,则Na2X的摩尔质量是??????????,X的相对原子质量是??????????。
参考答案:62 g·mol-1??16
本题解析:Na2X中含Na+ 0.4mol,则Na2X的物质的量是0.2mol,所以摩尔质量是12.4g÷0.2mol=62g/mol;X的相对原子质量是62-23×2=16。
本题难度:一般