微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,强酸溶液A和强碱溶液B的pH之和为15,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是
A.1︰10??
B.10︰1
C.1︰100
D.100︰1
参考答案:B
本题解析:常温下,强酸溶液A和强碱溶液B的pH之和为15,可以得到 ,带入PH的计算公式可以得到
,带入PH的计算公式可以得到 ,整理得到
,整理得到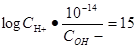 ,
,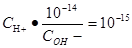 ,
, ,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B
,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B
本题难度:简单
2、选择题 盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
参考答案:C
本题解析:试题分析:A、在NaHCO3溶液中加入与其等物质的量的NaOH,碳酸氢钠和氢氧化钠恰好反应生成碳酸钠,碳酸钠是强碱弱酸盐能水解,碳酸根离子水解生成碳酸氢根离子,碳酸氢根离子水解生成碳酸,导致溶液中阴离子含有碳酸根离子、氢氧根离子、碳酸氢根离子,故A错误;B、碳酸氢钠溶液中根据物料守恒知,C(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),根据电荷守恒知C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),所以c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故B错误;C、反应后生成醋酸钠,醋酸钠是强碱弱酸盐能水解,醋酸根离子水解导致钠离子浓度大于醋酸根离子浓度,溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,醋酸钠以电离为主水解为次,所以各种离子浓度关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;D、氯化氢是强电解质,醋酸是弱电解质,PH值相同的盐酸和醋酸,醋酸的浓度远远大于盐酸,所以等体积的盐酸和醋酸,醋酸的物质的量远远大于盐酸的物质的量,中和体积与pH都相同的HCl溶液和CH3COOH溶液,所消耗的NaOH醋酸的多,盐酸的少,故D错误。
考点:电离平衡与溶液的pH专题;盐类的水解专题。
本题难度:困难
3、选择题 将0.1mol/L的下列物质的水溶液,从常温加热到80℃(不计水的蒸发),溶液的pH不变的是
A.NaCl
B.(NH4)2SO4
C.H2SO4
D.Ba(OH)2
参考答案:C
本题解析:加热时,水电离程度及盐的水解程度增大、Kw也增大,故A、B中溶液的pH变小;酸碱溶液的pH取决于酸碱电离出的c(H+)、c(OH-)的大小,但因c(H+)=Kw/c(OH-),故pH变小。
本题难度:困难
4、选择题 0.1 mol·L-1 Na2CO3和0.1 mol·L-1 NaHCO3溶液的pH,前后两个量的大小关系为
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:同浓度的Na2CO3与NaHCO3溶液中,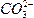 的水解程度比
的水解程度比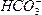 大得多,Na2CO3溶液的碱性强,故前者的pH大。
大得多,Na2CO3溶液的碱性强,故前者的pH大。
本题难度:一般
5、选择题 下列有关的叙述,正确的是
A.Cl2的水溶液能导电,但Cl2是非电解质
B.0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.常温下使pH为1的两份相同盐酸的pH均升高为2,需pH为13的NaOH溶液与水的体积比为1∶11(体积变化忽略不计)
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
参考答案:C
本题解析:
本题难度:困难