微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与CL2生成1 mol HCL总的过程需要 ( )
A.放热185kJ
B.吸热185kJ
C.放热92.5kJ
D.吸热92.5kJ
参考答案:C
本题解析:略
本题难度:简单
2、填空题 能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH= kJ/mol(用含有E1、E2代数式表示)。
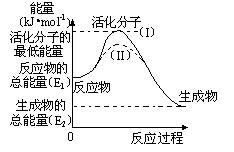
② 已知热化学 方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-
方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=- 241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 kJ/mol。
241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
。
参考答案:(1)+131.3
(2)① —(E1- E2)或(E
本题解析:略
本题难度:一般
3、选择题 已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436 kJ、243 kJ、432 kJ能量,则由H2与Cl2生成1 mol HCl总的过程需要( )
A.放热185 kJ
B.吸热185 kJ
C.放热92.5 kJ
D.吸热92.5 kJ
参考答案:C
本题解析:
试题分析:根据反应方程式H2+Cl2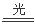 2HCl,可见每产生2mol的HCl需要断键消耗的能量是(436+243)KJ =679KJ,放出的能量是2×432 kJ=864KJ,因此生成1 mol HCl总的过程需要放出热量是(864KJ-679KJ)÷2="92.5" kJ。因此选项是C。
2HCl,可见每产生2mol的HCl需要断键消耗的能量是(436+243)KJ =679KJ,放出的能量是2×432 kJ=864KJ,因此生成1 mol HCl总的过程需要放出热量是(864KJ-679KJ)÷2="92.5" kJ。因此选项是C。
考点:考查键能与反应热的关系的知识。
本题难度:一般
4、选择题 下列关于催化剂的说法不正确的是
A.温度越高,催化剂的催化效果越好
B.汽车排气管上的“催化转化器”能减少有害气体排放
C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D.催化剂可以降低反应所需要的活化能,但不能改变反应热
参考答案:A
本题解析:
试题分析:适宜的温度下,催化剂的催化效果越好,故A错误。
考点:本题考查催化剂。
本题难度:一般
5、填空题 (12分)工业上合成甲醇一般采用下列反应: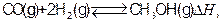 下表是该反应在不同温度下的化学平衡常数(K):
下表是该反应在不同温度下的化学平衡常数(K):

(1)由表中数据判断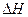 0(填“>”、“=”或“<”)。
0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为 ℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

①反应从2min到4min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2min时改变了反应条件,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压 下:
下:
①
②
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为: 。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为 L。
参考答案:(12分)
(1)<(1分) &
本题解析:略
本题难度:一般