微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在醋酸的电离过程中,加入水会使下列比值增大的是( )
A.
c(CH3COOH)
c(CH3COO-)
B.c(CH3COO-)
c(OH-)
C.c(H+)
c(CH
3
COOH)
D.c(H+)
c(OH-)
参考答案:A.加水稀释醋酸,促进醋酸电离,则n(CH3COO-)增大、
本题解析:
本题难度:一般
2、简答题 (12分) (1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质
| H2(g)
| Br2(g)
| HBr(g)
| 1 mol分子中化学键断裂时需要吸收的能量/kJ
| 436
| 200
| 369
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示: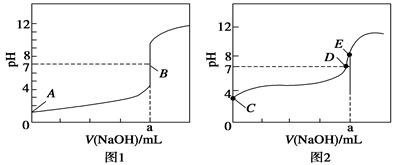
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
参考答案:(1)-72 kJ·mol-1 (2)
本题解析:
试题分析:(1)化学反应中化学键断裂吸收能量,形成化学键放出能量,反应热等于反应物的总键能减生成物的总键能。由化学键的键能可知H2(g)+Br2(g)=2HBr(g)△H=(436kJ/mol+200kJ/mol)-2×(369kJ/mol)=-102kJ/mol,因蒸发1mol Br2(l)需要吸收的能量为30kJ,则H2(g)+Br2(l)=2HBr(g)△H为=(-102kJ/mol)+(+30kJ/mol)=-72 kJ/mol。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,由于氢溴酸是强酸,因此有一种酸的pH=4,则该酸一定是氢溴酸,这说明乳酸是弱酸,所以乳酸钠溶液中的水解离子方程式为CH3CH(OH)COO- + H2O CH3CH(OH)COOH +OH-。 CH3CH(OH)COOH +OH-。
(3)①如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为氢溴酸滴定曲线,。
②滴定20.00mL 0.1000mol/L 氢溴酸溶液,NaOH和HBr恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HBr)=n(NaOH),则a=20.00mL。
③c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,故答案为:D。
④根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
考点:考查反应热计算、水解方程式、酸碱中和反应滴定曲线的有关判断
本题难度:困难
3、填空题 (1)某温度下纯水的c(H+)=2.0×10-7mol/L。在此温度下,某溶液中由水电离出的c(H+)为4.0× 10-13 mol/L,则该溶液的pH可能是____。
(2)分别将少量CO2气体通入一元酸的钠盐NaA和NaB的溶液中,发生的反应为:
①CO2+2NaA+ H2O==Na2CO3+2HA;
②CO2+NaB+H2O==NaHCO3+HB,
试由此推断H2CO3、HCO3-、HA、HB 的电离程度由大到小顺序为___。
(3)已知在相同条件下,HCN的电离程度比HF小。请根据有关知识分析判断,在相同温度下,物质的量浓 度相同的NaCN溶液和NaF溶液中: [c(CN-)+c(OH-)]____[f(F-)+c(OH-)]
(选填“等于”、“大于”或“小于”)。
参考答案:(1)1或 12.4(即l3-lg4)
(2)H2C
本题解析:
本题难度:一般
4、填空题 (12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]
参考答案:
本题解析:
本题难度:一般
5、选择题 25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是(??? )
A.I和II中H2O的电离程度不相等
B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小
C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量
D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+)
参考答案:D
本题解析:
试题分析: pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II)中的c(H+)=c(OH﹣)=0.001mol/L,因此对水电离的抑制作用相等,A错误;对I酸溶液进行稀释,溶液中OH-浓度越来越大,B错误;因为I是弱酸,II是强碱,若恰好完全中和得到的醋酸钠溶液也显碱性,所以C错误;若I和II等体积混合,则I中的醋酸过量,所以根据物料守恒c(CH3COO﹣)+ c(CH3COOH>c(Na+),故D正确;故选D。
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|
|