微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是(??)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是(??)

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
参考答案:D
本题解析:由题图知,开始时正反应速率增大,说明该反应为放热反应,放出的热量使容器内部温度升高,加快反应速率,则反应物的总能量应高于生成物的总能量,C项错误;达到平衡时,正逆反应速率不再随时间改变而改变,所以曲线上所有点均没达到平衡状态,反应均向正反应方向进行,反应物浓度逐渐降低,A、B两项错误,D项正确。
本题难度:一般
2、简答题 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g)?3C(g),已知加入1mol A和3mol B且达平衡后生成a?mol C,
回答下列问题:
(1)平衡时C在反应混合气体中的体积分数是?(用字母a表示).
(2)在相同实验条件下,若在同一容器中改为加入2mol A和6mol B,达平衡后,C的物质的量为?mol(用字母a表示).此时C在反应混合气中的体积分数?(填增大、减少或不变).
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C?mol.
(4)在同一容器中加入n?molA和3n?molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是?(用字母m、n表示).
参考答案:
本题解析:
本题难度:一般
3、选择题 在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)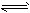 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是(????)
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是(????)

A.x=2?
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.A为气体,B为非气体,则平衡时M、N中C的物质的量相等?
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
参考答案:D
本题解析:
试题分析: D、若A、B均为气体,先让M与N在相同体积的条件下进行反应,平衡时是一等效平衡,因为正向是一体积减小的方向,再让M的体积减小,相当于增大压强,那么平衡会正向移动,导到M中A的转化率大于N中A的转化率,错误。
本题难度:一般
4、填空题 (11分)已知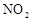 和
和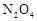 可以相互转化:
可以相互转化: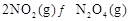 △H<0。现将一定量
△H<0。现将一定量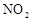 和
和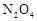 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。

(1)图中共有两条曲线X和Y,其中曲线________表示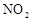 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收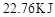 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。
(2)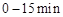 ,反应
,反应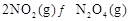 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在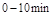 时平均反应速率
时平均反应速率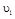 与
与 时平均反应速率
时平均反应速率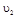 的大小__________。
的大小__________。
(3)反应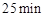 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
(4)若要达到使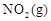 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在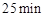 时还可以采取的措施是___________。
时还可以采取的措施是___________。
A.加入催化剂
B.缩小容器体积
C.升高温度
D.加入一定量的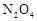
参考答案:(11分)(1)X(1分)??? 2NO2
本题解析:(1)根据图像可知,曲线X的浓度变化量是曲线Y的浓度变化量的2倍,所以根据方程式可知,X曲线表示NO2的浓度随时间的变化。根据图像可知,N2O4的浓度减少了0.6mol/L-0.4mol/L=0.2mol/L,物质的量是0.4mol,所以消耗1molN2O4的反应热是22.76kJ÷0.4mol=56.9kJ/mol,因此热化学方程式是2NO2 N2O4? △H=-56.9KJ/mol。
N2O4? △H=-56.9KJ/mol。
(2)根据图像可知,10min反应达到平衡,N2O4和NO2的浓度分别是0.4mol/L、0.6mol/L,所以反应的平衡常数是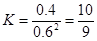 。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以
。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以 。
。
(3)根据图像可知,25min时NO2的浓度突然增大,而N2O4的浓度逐渐增大,所以改变的体积是增大了NO2的浓度;温度不变,所以平衡常数不变。
(4)催化剂不能改变平衡状态,A不正确;缩小容器容积,压强增大,平衡向正反应方向移动;升高温度,平衡向逆反应方向进行;加入一定量的N2O4,相当于增大压强,平衡向正反应方向进行,所以正确的答案选BD。
本题难度:一般
5、选择题 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表 ,下列说法错误的是(???)
,下列说法错误的是(???)