微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 如图所示,写出下列热化学方程式,并回答问题.

(1)______.
(2)______.
(3)Q1与Q2的关系:Q1______Q2(填“>”、“<”或“=”).
2、填空题 (1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
化学键
| H—H
| N—H
| N≡N
|
键能/kJ·mol-1
| 436
| 391
| 945
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。
3、简答题 SO2和O2是在催化剂表面上接触时发生反应的,所以这种生产硫酸的方法叫接触法,接触法制硫酸的工艺中SO2的转化率为90%,已知在101kPa?时每l?mol?SO2被氧化成l?mol?SO3放出热量98.3kJ,则下列热化学方程式正确的是( )
A.SO2(g)+ 1
2
O2(g)═SO3(g);△H=-98.3kJ?mol-1
B.2SO2(g)+O2(g)═2SO3(g);△H=-176.94kJ?mol-1
C.SO2(g)+1
2
O2(g)═SO3(g);△H=-88.47kJ?mol-1
D.2SO2(g)+O2(g)═2SO3(g);△H=+196.6kJ?mol-1
4、选择题 有关键能(破坏1 mol共价键吸收的能量)数据如表
化学键
| Si—O
| O===O
| Si—Si
| 键能/kJ·mol-1
| X
| 498.8
| 176
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)
A.423.3 B.460 C.832 D.920
5、填空题 下表是短周期中部分元素的原子半径及主要化合价。 请回答:
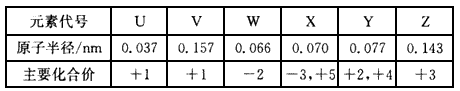
?(1)X在元素周期表中的位置是____。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是____。(用离子符号表示)。用离子方程式表示出Z离子可作净水剂的原因:____。
(3)某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:____。
(4)1 g YU4气体完全燃烧生成液态水时,放出akJ的热量,则该反应的热化学方程式为________。
(5)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合 液中c(Z3+ ):c(H+):c(Cl-)=1:2:8,则原固体混合物中,Z元素与W元素的质量比为____(最简整数比)。
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|