微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)在密闭容器中,通入xmolH2和ymolI2(g),改变下列条件,反应速率将如何改变?(填“增大”、“减小”或“不变”)
(1)升高温度 ;
(2)加入催化剂 ;
(3)容器容积充入H2 ;
(4)扩大容器的体积
(5)容器容积不变,通入氖气
2、选择题 下列实验中,反应速率加快是由催化剂引起的是 [???? ]
A.将炭块粉碎成粉末状,可使燃烧更加充分
B.过氧化氢中加入几滴氯化铁溶液,即可较快放出气体
C.在炭粉中加入氯酸钾,点燃时燃烧更为剧烈
D.用锌与稀硫酸反应制备氢气时,加入少量浓硫酸加快反应
3、选择题 (1)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)
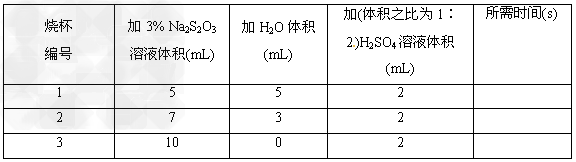
在三个烧杯(底部有黑色“十”字标记)内分别加入表中所示体?积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“十”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是____________________,因变量是______________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:____________________________________________________________________________________________________________________。
(2)373?K时,H2PO3-与OH-发生如下反应:H2PO3-+OH- HPO32-+?H2O 反应结果如下表所示
HPO32-+?H2O 反应结果如下表所示
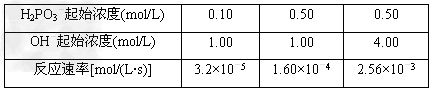
如果用v=kcm(H2PO3-)·cn(OH-)表示反应速率(k为与浓度无关的常数)
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20?mol/L,c(OH-)的起始浓度为1.50?mol/L,则反应速率v=
________。
4、填空题 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物的含量变化如下图所示。
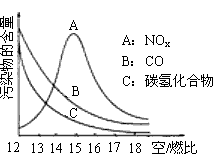
(1)稀薄燃烧技术除能节约能源外,还具有的优点是_____________(填一项)。排放到大气中的NOx会导致酸雨、____________等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能:NO、NH3混合气体-→催化反应器-→检测-→尾气处理。若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是____________。
?(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗的物质的量较多的可能是___________(填字母),原因是_______________。A.① B.② C.都有可能
5、简答题 硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究______对化学反应速率的影响.
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
实验
组号 | 温度 | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间
体积
浓度
体积
浓度
Ⅰ
0℃
5mL
0.1mol?L-1
10mL
0.1mol?L-1
5mL
8s
Ⅱ
0℃
5mL
0.1mol?L-1
5mL
0.1mol?L-1
10mL
12s
Ⅲ
30℃
5mL
0.1mol?L-1
5mL
0.1mol?L-1
10mL
4s
结论1:由Ⅰ和Ⅱ两组数据可知______;
结论2:由Ⅱ和Ⅲ两组数据可知______.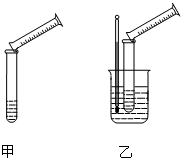
|