微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
实验编号
| KClO3(g)
| 氧化物
| 产生气体(mL)(已折算为标况)
| 耗时(s)
|
化学式
| 质量(g)
| 实际回收
|
1
| 0.6
| —
| —
| —
| 10
| 480
|
2
| 0.6
| MnO2
| 0.20
| 90%
| 67.2
| 36.5
|
3
| 0.6
| CuO
| 0.20
| 90%
| 67.2
| 79.5
|
4
| 0.6
| Fe2O3
| 0.20
| 90%
| 67.2
| 34.7
|
5
| 0.6
| Cr2O3
| 0.20
| 异常
| 67.2
| 188.3
|
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
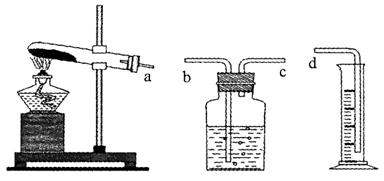
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ 。
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 。
2、选择题 工业上用H2和N2直接合成氨: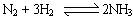 ,下列措施肯定能使合成氨反应速率加快的是
,下列措施肯定能使合成氨反应速率加快的是
①升高温度??②加入正催化剂??③增大反应物浓度??④增大压强
A.只有①②③
B.只有①②④
C.只有①③④
D.①②③④
3、选择题 下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号
| 金属(粉末状)
| 酸的浓度
| 酸的体积
| 反应温度
|
A
| 0.1mol Mg
| 6mol/L硝酸
| 10mL
| 30℃
|
B
| 0.1mol Mg
| 3mol/L盐酸
| 10mL
| 60℃
|
C
| 0.1mol Fe
| 3mol/L盐酸
| 10mL
| 60℃
|
D
| 0.1mol Mg
| 3mol/L盐酸
| 10mL
| 30℃
?
4、选择题 (1)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)
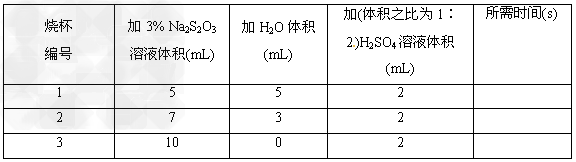
在三个烧杯(底部有黑色“十”字标记)内分别加入表中所示体?积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“十”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是____________________,因变量是______________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的 影响,简述实验方法:____________________________________________________________________________________________________________________。
(2)373?K时,H2PO3-与OH-发生如下反应:H2PO3-+OH- HPO32-+?H2O 反应结果如下表所示 HPO32-+?H2O 反应结果如下表所示
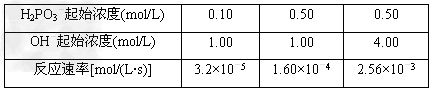
如果用v=kcm(H2PO3-)·cn(OH-)表示反应速率(k为与浓度无关的常数)
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20?mol/L,c(OH-)的起始浓度为1.50?mol/L,则反应速率v=
________。
5、填空题 ?某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| ??? A
| ??? B
| ??? C
| ??? D
| ??? E
| ??? F
| 4mol/L ?H2SO?4/mL
| ?? 30
| ?? V1
| ???V2
| ??? V3
| ?? V4
| ?? V5
| 饱和CuSO4溶液? /mL
| ??? 0
| ?? 0.5
| ??? 2.5
| ?? 5
| ?? V6
| ?? 20
| H2O?? /mL
| ?? V7
| ?? V8
| ?? V9
| ?? V10
| ?? 10
| ??? 0
①请完成此实验设计,其中:V1=??????,V6=??????,V9=??????;
②?该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因????????????????
|
|