微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA代表阿伏加德罗常数,下列关于0.2mol/L的Ba(NO3)2溶液的说法中不正确的是 [???? ]
A.1L溶液中含有0.2NA个NO3-
B.1L溶液中所含的阴、阳离子总数为0.6NA个
C.0.5L溶液中Ba2+浓度是0.1mol/L
D.500mL溶液中,含有NO3-的物质的量为0.2mol
参考答案:AC
本题解析:
本题难度:简单
2、选择题 把0.05mol醋酸分别加入到下列100mL溶液中,溶液的导电能力变化最明显的( )
A.0.5mol/LNaOH溶液
B.0.5mol/L盐酸
C.0.5mol/LNH4Cl溶液
D.0.5mol/L氨水
参考答案:A、100mL0.5mol/LNaOH溶液中加入0.05mo
本题解析:
本题难度:一般
3、选择题 2a LFe2(SO4)3和(NH4)2SO4的混合液分成两等份,向其中一份加入b mol的BaCl2溶液,恰好使溶液中的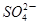 完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为(???)mol·L-1
完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为(???)mol·L-1
A.
B.
C.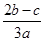
D.
参考答案:C
本题解析:
试题分析:由题意可知每份含有n(SO42-)="b" mol ;n(NH4+)=cmol,则含有(NH4)2SO4的物质的量为n((NH4)2SO4)="c/2mol." 含有Fe2(SO4)3的物质的量为n(Fe2(SO4)3)="{" ( b- c/2)÷3} mol.所以原溶液中Fe3+的物质的量浓度为{ ( b- c/2)÷3} ×2mol/aL="(2b-c)/3" mol/L.选项为:C。
本题难度:一般
4、选择题 将50mL0.2mol/L的NaCl溶液加水稀释成0.1mol/L的NaCl溶液时,稀释后溶液的体积为( )
A.100mL
B.200mL
C.150mL
D.50mL
参考答案:令稀释后溶液的体积为V,根据稀释定律,稀释前后溶质氯化钠的物
本题解析:
本题难度:一般
5、计算题 (8分)将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:,

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL;
(4)试计算V2的值: V2= mL。
参考答案:(1)0.12 (2)H++OH-=H
本题解析:
试题分析:在0~V1段没有沉淀生成,是NaOH溶液与过量的盐酸反应n(HCl)=n(NaOH)=0.16L3mol/L=0.32mol,那么与镁、铝的混合物反应的盐酸的物质的量为:0.2L×4mol·L—1-0.32mol=0.48mol,(1)设镁、铝的物质的量分别为xmol、ymol,根据:Mg +2 H+=Mg 2+ +H2↑,2Al + 6H+=Al3++ 3H2↑,
x 2x y 3y
则有:x+y=0.2 2x + 3y=0.48 得:x="0.12" mol y=0.08mol。(2)0~V1段是NaOH溶液与过量的盐酸反应,离子方程式为:H++OH-=H2O(3)Mg 2+ +2OH-=Mg(OH)2↓, Al3+ + 3 OH-=Al(OH)3↓, 0.12 mol 的Mg 2+和0.08mol的Al3+刚好沉淀需要的NaOH物质的量为:0.12mol×2+0.08mol×3=0.48mol,总共需要的NaOH的物质的量为:0.48mol+0.32mol=0.8mol,NaOH溶液的体积为:0.8mol÷2mol·L="0.4L=400" mL;(4)继续加入NaOH溶液,Al(OH)3发生溶解,0.08mol的Al(OH)3溶解需要0.08mol的NaOH物质的量为:0.08mol ,Al(OH)3刚好溶解消耗的NaOH的物质的量为:0.8+0.08=0.88mol,体积为:0.88mol÷2mol·L="0.44L=440" mL;
考点:化学图像和有关物质的量的计算。
本题难度:一般