微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题  下列各组离子可能大量共存的是(????):
下列各组离子可能大量共存的是(????):
A.pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32-
D.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
参考答案:D
本题解析:
试题分析:pH=1的溶液中,Fe2+、HCO3-、MnO4-都不能大量共存,A错;能与金属铝反应放出氢气的溶液,或强酸性或强碱性,所以NH4+不能大量共存,B错;有大量OH-的无色溶液中,Cu2+不能大量共存,C错。答案选D。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al
本题难度:一般
2、填空题 亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
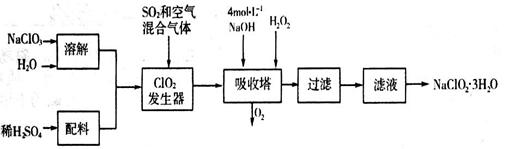
已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1)吸收塔内发生反应的化学方程式为_____________________(配平化学方程式)。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为________克。
(2)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸馏????? b.灼烧????? c.过滤????? d.冷却结晶
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:

①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为____________;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是_______;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时的S2-的浓度为____。
已知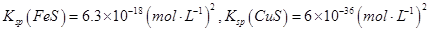
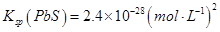
参考答案:(14分)(1)2NaOH+2ClO2+H2O2=2NaCl
本题解析:
试题分析:(1)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,因此反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;二氧化氯和浓盐酸制取Cl2时,二氧化氯中氯元素的化合价从+4价降低到0价,得到4个电子。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,则根据电子的得失守恒可知,氧化剂和还原剂大的物质的量之比是1:4,还原产物和氧化产物的物质的量之比也是1:4。因此当生成
本题难度:困难
3、选择题 某无色溶液中加入过量盐酸有白色沉淀产生,过滤后向滤液中加入过量氨水又有白色沉淀产生。下列溶液符合此条件的是(??)
A.Ag+、Fe3+、K+
B.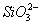 、
、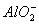 、K+
、K+
C.Ag+、Cu2+、Na+
D.Ag+、Ba2+、Na+
参考答案:B
本题解析:加入过量盐酸时,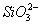 与H+结合生成硅酸白色沉淀,
与H+结合生成硅酸白色沉淀,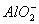 与过量盐酸反应生成Al3+,过滤后再加入过量氨水,Al3+与氨水反应生
与过量盐酸反应生成Al3+,过滤后再加入过量氨水,Al3+与氨水反应生
本题难度:一般
4、填空题 近年来,太湖蓝藻爆发,造成无锡市水质的严重恶化。这些事件再次敲响了我国水危机的警钟。在太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、 、
、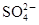 。为了进一步确认,取样进行实验检测:
。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是___________,肯定没有的离子是___________,可能含有的离子是___________。
(2)如何通过实验进一步确定溶液中可能存在的离子__________________________________。
参考答案:(1)Ba2+、OH-?????????Fe3+、![]()
本题解析:本题利用社会热点问题结合离子共存和离子检验考查离子反应问题。(1)由①知肯定无Fe3+,由②知肯定有Ba2+,则无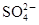 和
和
本题难度:一般
5、选择题 室温下,下列叙述正确的是(溶液体积变化忽略不计)?
?
| ①
| ②
| ③
| ④
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸
| 盐酸
|
pH
| 11
| 11
| 3
| 3
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.①、④两溶液等体积混合,所得溶液中c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.②、③两溶液混合,若所得溶液的pH=7,则c(CH3COO-)>c(Na+)
D.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
参考答案:D
本题解析:
试题分析:氯化铵能抑制氨水的电离,另外氯化铵还能和氢氧化钠反应生成氨水,所以溶液的pH均是降低的,A不正确;B不正确,不符合电荷守恒c(C1-)+c(OH-)=c(NH4+)+c(H+);C不正确,也是不符合电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),即若所得溶液的pH=7,则c(CH3COO-)=c(Na+);醋酸在稀释过程中,会
本题难度:一般
|