微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将40?mL?1.5?mol·L-1的CuSO4溶液与30?mL?3?mol·L-1的NaOH溶液混合生成浅蓝色沉淀,假如溶液中Cu2+或OH-浓度都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2
B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2
D.CuSO4·3Cu(OH)2
参考答案:D
本题解析:Cu2+或OH-浓度都已变得很小,说明二者恰好反应。硫酸铜和氢氧化钠的物质的量分别是0.06mol和0.09mol,则铜离子和OH-的物质的量之比是2︰3,而只有选项D中符号,所以正确的答案选D。
本题难度:困难
2、选择题
A.可以用分液漏斗分离甘油和水的混合物
B.除去CO2中的少量CO可以通入O2后点燃
C.不用任何其它试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
D.检验溴乙烷中的溴元素,可以加入氢氧化钠溶液煮沸,冷却后再加入硝酸银溶液
参考答案:C
本题解析:本题考查内容涉及混合物的分离,物质的鉴别,中等难度题。甘油和水互溶,A错误。CO属可燃性气体,混合气体直接点燃,极易发生爆炸,存在安全隐患,B错误。根据NaOH溶液和Al2(SO4)3溶液滴加方向不同,发生反应的现象不同即可将两者分离,C正确。检验溴乙烷中溴元素,加入硝酸银溶液之前必须加过量硝酸中和溶液中剩余的NaOH溶液,故D错误。
本题难度:一般
3、实验题 某研究性学习小组对还原铁粉与水蒸气的反应产物进行科学探究。已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃:根据下图所示实验装置,进行了还原铁粉与水蒸气的反应实验,实验中观察到肥皂液中产生了大量的气泡。
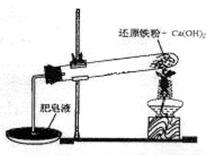
(1)实验中Ca(OH)2的作用是????????????。实验中产生的气体产物是???????。
(2)为进一步探究还原铁粉与水蒸气反应固体产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体,针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:固体为Fe3O4
假设三:???????????????????????
①限选用下列试剂:盐酸、KSCN溶液、K3Fe(CN)6 溶液、氯水,证明假设一不成立
操作
| 现象
| 结论
|
?
| ?
| 假设一不成立
?
②为了进一步确定产物的成分,用黑色固体进行了下列实验:

加入足量氯水所发生反应的离子方程式是 ?????????????????????????;检验红褐色固体是否洗涤干净的操作是????????????????????????????????????????????;灼烧时盛放固体的仪器是?????????;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是???? g
参考答案:(1)提供反应所需的水蒸气?? H2
(2)固体为Fe
本题解析:
试题分析:(1)Fe与水蒸气反应应得到的是铁的氧化物和H2。因此,反应物水蒸气可以有580℃以上高温分解Ca(OH)2得到.(2)因为氧化铁是红色,而产物是黑色,故产物固体为FeO或Fe3O4或二者的化合物三种情况。①当实验证明固体产物有+3价铁时,假设一不成立。实验操作是取适量固体于试管中,加入盐酸加热溶解,再加入KSCN溶液,振荡,溶液出现红色。②固体产物用盐酸溶解后,加入氯水可将Fe2+氧化为Fe3+(2Fe2++Cl2=2Fe3++2Cl-)。红褐色固体Fe(OH)3中吸附了少量NaCl,用水洗涤2~3次,取最后一次洗涤液于试管中,再用稀硝酸酸化,再加入AgNO3溶液,若没有浑浊,则洗涤干净。固体灼烧的仪器是坩埚。
由Fe3O4~ 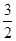 Fe2O3,5.8g Fe3O4产生6g Fe2O3。 Fe2O3,5.8g Fe3O4产生6g Fe2O3。
本题难度:一般
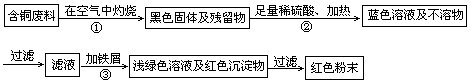
4、实验题 (16分)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案: 2CuSO4+2H2O ) ,于是他提出了另一套方案:
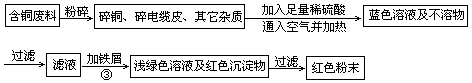
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①????????????????????????????;③???????????????????????????????。
(2)从环保角度对两套方案的不同部分进行比较,你认为???????(填“甲”或“乙”)方案更合理,理由是:???????????????????????????????????????????????????。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是:?????????????????????????????。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法:??????????????????????????????????。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会???????????????????????????????。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸???????????????g,需水?????????mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的:?????????????????????????。
参考答案:(1)2Cu+O2 本题解析: 本题解析:
试题分析:结合题中信息可以得出(1)、 (2)、 (3) 、(4)的答案。
(1)2Cu+O2 2CuO;Fe+CuSO4=FeSO4+Cu;; 2CuO;Fe+CuSO4=FeSO4+Cu;;
(2)乙;甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;;
(3)将Cu完全置换出来;将所得铜粉酸洗后再洗涤、干燥;
(4)水污染或环境污染;
(5)能配制出这种稀硫酸xg,则xg×36.8%=1000mL×1.84g/mL×98%,x=4900:其中浓硫酸的质量为1840g,所以需加水3060g。
本题难度:一般
5、填空题 (5分)对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成成份而进行了如下实验,但实验中的有些问题还需你来作答。
(1)甲取少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲说肯定有一种物质不存在。这种物质的化学式是:______________
(2)甲又先后向那试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡。因此甲又说肯定有两种物质存在。这两种物质是:______________、_____________。
(3)乙将甲所得混合物进行了过滤,取滤液约2ml盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙说那份白色固体中也肯定有NaCl。你说乙的结论(填“对”或“不对”)__________,理由是:________________
参考答案:(1)CuSO4 (2) Na2CO3、Na2SO4 (3)
本题解析:略
本题难度:简单
|