微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
[???? ]
A.任何反应中的能量变化都表现为热量变化
B.物质发生化学变化都伴随着能量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
参考答案:B
本题解析:
本题难度:简单
2、简答题 (14分)已知用NaAlO2制备α—Al(OH)3及能量转化关系如图:
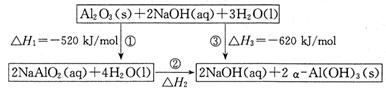
(1)反应②的热化学方程式为??????????????????????????。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下:

①物质A的化学式为???????????;
②步骤Ⅲ的化学反应方程式为????????????????????????????????????;检验步骤Ⅲ中沉淀是否洗净的方法是??????????????????????????;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是???????????????;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为???????mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为??????????????。
参考答案:(14分)
(1)NaAlO2(aq)+2H2O(l)
本题解析:
试题分析:(1)首先写出反应②的化学方程式并注明状态NaAlO2(aq)+2H2O(l) = NaOH(aq)+α—Al(OH)3(s)根据盖斯定律求出该反应的焓变?H=?—1/2?H1 + 1/2?H3=—50kJ?mol?1,可得热化学方程式为。
(2)①Al2O3为两性氧化物,所以物质A为NaOH。
②步骤Ⅲ为Al(OH)3焙烧分解生成Al2O3,所以化学方程式为:2Al(OH)3 本题难度:一般
本题难度:一般
3、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g)  ?SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为?????(?)
?SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为?????(?)
A.196.64kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
参考答案:C
本题解析:略
本题难度:简单
4、实验题 某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。?
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。?
名称
| 托盘天平
(带砝码)
| 小烧杯
| 坩埚钳
| 玻璃棒
| 药匙
| 量筒
|
仪器
| 
| 
| 
| 
| 
| 
|
序号
| a
| b
| c
| d
| e
| f
?
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。?
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验
次数
| 起始温度t1/℃
| 终止温度
t2/℃
| 温度差平均值
(t2-t1)/℃
| H2SO4
| NaOH
| 平均值
| 1
| 26.2
| 26.0
| 26.1
| 30.1
| ?
| ?
| 2
| 27.0
| 27.4
| 27.2
| 33.3
| ?
| 3
| 25.9
| 25.9
| 25.9
| 29.8
| ?
| 4
| 26.4
| 26.2
| 26.3
| 30.4
| ?
?
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。?
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。?
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)10.0 (2)abe
Ⅱ.(1)环形玻璃搅
本题解析:考查一定物质的量浓度溶液的配制、中和热的测定以及误差分析等
Ⅰ.(1)由于没有470 mL的容量瓶,所以应该配制500 mL 0.50 mol·L-1NaOH溶液。所以需要氢氧化钠的质量是500 mL×10-3×0.5 mol/L×40 g/mol="10.0" g。
(2)氢氧化钠具有腐蚀性和吸水性,所以应该放在烧杯中称量,同时还需要药匙取NaOH固体,所以正确的答案选abe。
Ⅱ.(1)在中和热的测定实验中,溶液是需要搅拌的,所以还缺少环形玻璃搅拌棒。
(2)①四次实验的温度差
本题难度:一般
5、选择题 已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
参考答案:A
本题解析:
试题分析:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,1mol碳完全燃烧生成二氧化碳放出的热量比生成一氧化碳放出热量多,∣△H3∣>∣△H1∣,A正确;中和热是指稀溶液中强酸和强碱生成1molH2O放出的热量,C中浓硫酸溶于水也要放出热量,D中醋酸电离需要吸收热量。
点评:准确理解燃烧热和中和热的概念。
本题难度:一般
|
|