微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。

|
实验操作和现象

⑴A中反应的化学方程式是_______________。
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象
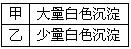
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:______________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
参考答案:⑴Cu+2H2SO4![]() 本题解析:
本题解析:
本题难度:困难
2、填空题 用Na2CO3沉淀CaCl2溶液中的钙离子,如何检验Ca2+已经沉淀完全______.
参考答案:CaCl2和Na2CO3反应生成碳酸钙和氯化钠,Na2CO3
本题解析:
本题难度:一般
3、选择题 下列实验设计能够成功的是????????????????????????????????????????????(???)
?
| 实验目的?
| 实验操作????
|
A
| 实验室制备硝基苯
| 将苯和浓硝酸混合后加热
|
B
| 除去硫酸钠溶液中少量氯化钠杂质
| 向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤
|
C
| 检验溴乙烷发生消去反应的产物
| 向盛有少量溴乙烷的试管中,先加入氢氧化钠溶液,加热,再滴人用硝酸酸化 的硝酸银溶液 的硝酸银溶液
|
D
| 浓硝酸的氧化性强于稀硝酸
| 向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片
?
参考答案:D
本题解析:略
本题难度:一般
4、简答题 某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),以探索工业废料的再利用.其实验方案如图:

试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径______(填“I”或“II”),理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):______.
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为______.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?______.理由是______.
参考答案:(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠
本题解析:
本题难度:一般
5、实验题 为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
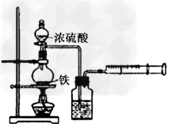
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是___________________。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式________________。活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。 ????
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);
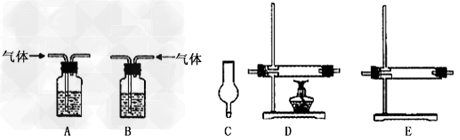
①连接仪器。将装置的字母填入方框内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是____________________?。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有_____。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为___________?;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为__________mol。
参考答案:(1)①?干燥气体;②?2Fe+6H2SO4(浓)![]()
本题解析:
本题难度:一般
|